已知热化学方程式:SO2(g)+1/2O2 (g) SO3(g) △H=-98.32kJ??mol—1,
SO3(g) △H=-98.32kJ??mol—1,
在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.98.32kJ | C.<196.64kJ | D.>196.64kJ |
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=+73 kJ·mol-1 |
| B.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-73 kJ·mol-1 |
| C.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=+18 kJ·mol-1 |
| D.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-18 kJ·mol-1 |
燃烧10g CH4生成液态水和气态CO2,放出556.5kJ的热量,以下的热化学方程式正确的是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=55.65kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-55.65kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.4kJ/mol |
| D.CH4(g)+2O2=CO2+2H2OΔH=890.4kJ/mol |
下列热化学方程式中,△H能正确表示物质的燃烧热的是
| A.CO(g) +1/2O2(g) =CO2(g) △H=-283.0 kJ/mol |
| B.C(s) +1/2O2(g) =CO(g) △H=-110.5 kJ/mol |
| C.H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol |
| D.2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) △H=-11036 kJ/mol |
肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是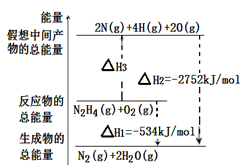
| A.194 | B.391 | C.516 | D.658 |
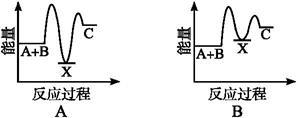
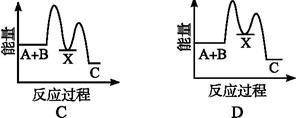
反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0);②X→C(ΔH<0)。下列示意图中;能正确表示总反应过程中能量变化的是