关于硫原子核外电子的叙述错误的是( )
| A.排布在K、L、M三个电子层上 | B.3p亚层上有2个空轨道 |
| C.共有16种不同的运动状态 | D.共有5种不同能量的电子 |
.根据元素在元素周期表中的相对位置,判断下列化合物中,化学键极性最大的是:
| A.H2S | B.CH4 | C.NH3 | D.H2O |
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为
超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。
则有关下列说法正确的是: 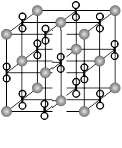
| A.KO2中只存在离子键 |
| B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2- |
| C.晶体中与每个K+距离最近的O2-有6个 |
| D.晶体中,所有原子之间都是以离子键结合 |
.下列电子式中,正确的是:

下列判断错误的是:
A.沸点: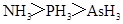 |
B.熔点: |
C.酸性: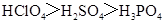 |
D.碱性: |
短周期元素中,原子基态时具有1个未成对电子的元素共有多少种:
| A.5 | B.6 |
| C.7 | D.8 |