“碘钟”实验中,3I—+ S2O32- = I3—+SO42-的反应速率可以用I3—与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I—)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O32-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.120 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
| A.<22s | B.22—44s | C.>44s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是 。
NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
(1)写出上述实验过程中所用试剂(写化学式):
试剂①_______________________;试剂③________________________。
(2)判断试剂①已过量的方法是:________________________________________。
(3)用化学方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉(填“能”或“不能”)透过半透膜;
SO42-(填“能”或“不能”)透过半透膜;
请用实验证明上述结果,完成下表(可不填满,也可增加):
限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、
碘水、稀盐酸、稀硝酸
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
||
| ② |
||
下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:②花生油和水:
(3)下列关于仪器的使用说法正确的是
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于向酒精灯中添加酒精
C.C仪器在放出液体时应打开上边的瓶塞
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.制蒸馏水时E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?
(5)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:
A.汽油 B.CCl4 C.酒精 D.醋酸
实验室用Na2CO3·10H2O晶体配制0.02 mol/L的Na2CO3溶液480 mL。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ;
② 实验中两次用到玻璃棒,其作用分别是 、 。
(2) 应用托盘天平称取Na2CO3·10H2O晶体的质量为: g。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠晶体失去了部分结晶水;②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠;④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有 ;
b.偏低的有 ;
c.无影响的有 。
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)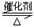 2SO3(g)ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g)ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| n(SO2) |
2.00 |
1.92 |
1.84 |
1.76 |
1.76 |
1.64 |
1.52 |
1.40 |
1.40 |
1.40 |
| n(O2) |
1.00 |
0.96 |
0.92 |
0.88 |
0.88 |
0.82 |
0.76 |
0.70 |
0.70 |
0.70 |
| n(SO3) |
0 |
0.08 |
0.16 |
0.24 |
0.24 |
0.36 |
0.48 |
0.60 |
0.60 |
0.60 |
回答下列问题:
(1)___________________________时段,反应处于平衡状态。
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。,Fe2O3和NiO作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe2O3的 主要优点是_____________。
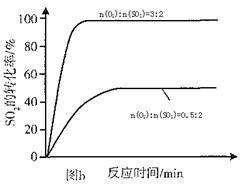
(4)科研小组在3800C Fe2O3作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线。
氯气在298K、100kPa时,在1L水中可溶解0.090mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________;
(2)根据离子方程式,计算该反应的平衡常数(水视为纯液体,列式计算,保留2位有效数字)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;(填“正”、“逆”或“不”)
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。(填“正”、“逆”或“不”)
(5)新制氯水经光照一段时间后溶液c(H+)增大,请运用平衡移动原理进行解释:__________________。