下列实验方案合理的是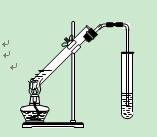
| A.无水乙酸和乙醇共热制取乙酸乙酯 |
| B.鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 |
| C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D.制取乙酸乙酯:用如右图所示的实验装置 |
下列烷烃在光照下与氯气反应,生成的一氯代烃只有一种的是
| A.CH3CH2CH2CH3 | B. |
C. |
D. |
下列分子中, 所有原子不可能处在同一平面上的是
| A.乙烷 | B.乙烯 | C.氯乙烯(CH2=CHCl) | D.苯 |
某烷烃含有200个氢原子,那么该烃的分子式是
| A.C97H200 | B.C98H200 | C.C99H200 | D.C100H200 |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.15 mol CO2和3.6 g H2O,下列关于该混合气体的说法正确的是
| A.一定有乙烯 | B.一定没有乙烯 | C.一定有甲烷 | D.一定没有乙烷 |
乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中、断裂键的说法不正确的是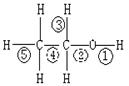
| A.乙醇和钠反应,键①断裂 |
| B.在铜催化下和O2反应,键①③断裂 |
| C.乙醇制乙烯时,键②⑤断裂 |
| D.在铜催化下和O2反应,键①②断裂 |