在化学实验操作中,往往由于读数不规范导致较大的实验误差。下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)
| A.配制500mL 1mol/L稀硫酸实验中,用量筒量取181mol /L浓硫酸时俯视读数 |
| B.配制1mL 51mol/L氯化钠溶液实验中,定容时仰视 |
| C.用标准盐酸滴定特测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数 |
| D.用标准NaOH溶液滴定特测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数 |
下列热化学方程式正确的是(注: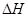 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
关于化学反应,下列叙述中不正确的是()
①放热的反应发生时不必加热②化学反应一定有能量变化③吸热反应需要加热后才能发生④化学反应热效应数值(放出或吸收的热量)与参加反应的物质的多少有关
A.①② B.②③ C.①③ D ②④
已知反应:2 E (l)  U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是()
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如图所示。则下列说法正确的是()
| A.该反应的∆H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有:∆n (E,20℃) = ∆n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb
Pb +CO;PbO+CO
+CO;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是()
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,发生还原反应 |
| C.过程②中,制取1molPbO共转移2mol电子 |
| D.将1molPbS冶炼成Pb理论上至少需要6g碳 |
钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是 ( )
| A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl |
| B.充电时阳极的电极反应为Na++e-===Na |
| C.放电时正极的电极反应为Ni2++2e-===Ni |
| D.该电池被称为绿色电池,最大原因是从废弃电池中可以 |
方便地回收较纯的镍,其他产物对环境没有影响