将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
室温下,某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
| A.NaHSO4 | B.NaCl | C.HCl | D.Ba(OH)2 |
下列说法正确的是( )
A.水的电离方程式:H2O H++OH- H++OH- |
| B.升高温度,水的电离程度增大 |
| C.在NaOH溶液中没有H+ |
| D.在HCl溶液中没有OH- |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4 2H++S
2H++S
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
一元弱酸HA(aq)中存在下列电离平衡:HA A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )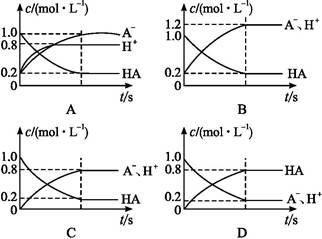
在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-,对该平衡,下列叙述正确的是( )
H++CN-,对该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,平衡向逆反应方向移动 |
| C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少 |
| D.加入少量NaCN固体,平衡向正反应方向移动 |