A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示: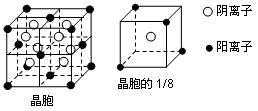
(1)A和E所形成的化合物的电子式是
(2)A、B、C、D四种元素的原子半径由小到大的顺序为 (用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是____________
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有 个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数) 。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______(写化学式),
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为________________________________________________________________________。
前四周期元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。W可以与Y组成YW型化合物。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子中的化学键类型;
(2)X单质与水发生主要反应的化学方程式为;
(3)X的氢化物沸点与同主族下一周期的元素的氢化物的沸点比较,沸点较高的是 ( 用化学式表示)原因是
(4)含有元素Z的盐的焰色反应为色。许多金属的盐都可以发生焰色反应,其原因是。
根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,在元素周期表中的位置是____________________。
(2)C元素基态原子的电子排布图是下图中的_______(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______(从A B C中选择)。
A.能量最低原理 B.泡利原理 C.洪特规则
(3)依据正负化合价代数和等于0,H元素可以放在周期表中的族
(4)氯化铵的电子式
已知:①红磷在氯气中燃烧可以生成两种化合物——PCl3和PCl5,氮与氢也可形成两种化合物——NH3和NH5。
②PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道,PCl5分子呈三角双锥形( )。
)。
(1)NH3、PCl3和PCl5分子中,所有原子的最外层电子数都是8个的是________(填分子式),该分子空间构型是______________。
(2)有同学认为,NH5与PCl5类似,N原子的1个2s轨道、3个2p轨道和1个2d轨道可能发生sp3d杂化。请你对该同学的观点进行评价__________________________
(3)经测定,NH5中存在离子键,N原子最外层电子数是8,所有氢原子的最外层电子数都是2,则NH5的电子式是________。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被——NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子空间构型为,N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g);△H=-1 038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)。
a.离子键 b.共价键
c.配位键 d.范德华力
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出12种元素的X的数值:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
N |
| X的数值 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系______________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机物结构简式为: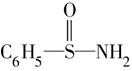 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
(5) 预测元素周期表中,X值最小的元素位置________(放射性元素除外)。