已知化学能与其他形式的能可以相互转化。填写下表的空白:
| 化学反应方程式(例子) |
能量转化形式 |
| ① |
由化学能转化为热能 |
②Pb+PbO2+2H2SO4 2PbSO4+2H2O 2PbSO4+2H2O |
|
③CaCO3 CaO+CO2↑ CaO+CO2↑ |
|
上述反应中属于氧化还原反应的是(填序号) 。
在某有机物A,其结构简式如图。请写出以下化学反应的方程式。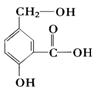
①A跟NaOH溶液反应:。
②A跟NaHCO3溶液反应:。
③A在一定条件下跟Na反应:。
(10分)已知:2CH2=CH2+O2 2CH3CHO,以乙烯、空气、水为原料在一定条件下能实现如下图所示的转化。
2CH3CHO,以乙烯、空气、水为原料在一定条件下能实现如下图所示的转化。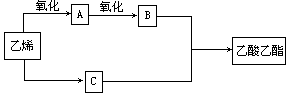
(1)物质C俗称_________,其结构简式为_____________;
(2)写出由A→B的化学方程式____________________________;
(3)写出由B+C→乙酸乙酯的化学方程式____________________
该反应是___________反应。
在世纪之交,罗马尼亚的炼金废水汇入尼罗河,导致大量鱼类等水生物死亡,造成世界级 的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结
的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结 合时生成剧毒的HCN。完成下列问题:
合时生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,其电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.1mol NaCN和0.05mol HCl全部溶于水,形成混合溶液(假设无损失),
①___和___两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比H+多0.05mol。
在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
⑴电解后得到的Cu的质量是,得到O2的体积(标准状况)是,溶液的pH是。
⑵如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的pH(填“变小”、“变大”或“不变”)
将等物质的量A、B气体,置于容积为2L的密闭容器中发生反应,当反应进行到8s末,达到该反应的限度,测得A的物质的量减少0.6mol,B的物质的量减少0.2mol,C的物质的量增加0.4mol,此时n(A):n(B):n(C)=1:2:1。
则:
(1)该反应的化学方程式为:;
(2)用生成物C表示的该反应的速率为:;
(3)反应前A、B的物质的量浓度是:。