⑴一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。若反应物的总能量 (填“>”、“<”、“=”)生成物的总能量,该反应就放出能量;若反应物的总能量 生成物的总能量,该反应就吸收能量。
⑵普通锌锰酸性干电池的内部结构如图所示,请回答
①该电池的负极材料为 该电极反应为
②正极材料为 ,正极得到电子的氧化剂为
③电解质为
⑶化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。若时间用秒表示,则化学反应速率的单位是 。
⑷在外界条件不变的情况下,一个可逆反应达到的最大限度是该反应达到 状态。
已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓) CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)在参加反应的硫酸中,被还原的硫酸与未被还原的硫酸的物质的量之比为 。A物质可以与强碱反应生成盐和水。则A应该属于 (用字母代号填写)。
a.酸
b.碱
c.盐
d.酸性氧化物
e.碱性氧化物
(2)一定量的铜片与含1.8mol H2SO4的浓H2SO4充分反应(浓H2SO4过量),如果该反应过程中转移了0.2 mol电子,生成的CuSO4的质量为 g,生成的A气体在标准状况下体积为 L(假设气体全部逸出)。
(3)将(2)中反应后所得到的溶液稀释后与足量Ba(OH)2溶液反应,所得沉淀的质量为 g。写出此过程中发生反应的离子方程式:
,
。
实验室要配制0.1mol/L的稀硫酸980mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸 ______ mL
(2)配制时,必须使用的仪器有______(填代号)还缺少的仪器是______、______。
①烧杯 ②10 mL量筒③20 mL量筒 ④托盘天平(带砝码) ⑤玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是______、______。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①用量筒量取98%的硫酸时俯视。()
②如果加水超过了刻度线,取出水使液面恰好到刻度线。()
③容量瓶没有干燥。()
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C + K2Cr2O7+ H2SO4(稀)="=" CO2+ K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11.2 L(标准状况下)的气体物质,则转移的电子数目为 。
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HNO3反应时,主要还原产物为N2O气体;当HNO3更稀时,其主要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 。
(2)a点到b点的还原产物是 ,其原因可能是 。
(3)试完成b点到c点的反应方程式:
□Fe+□HNO3——□Fe( NO3)3+□[ ]+□H2O
(4)反应过程中,到达 点时,HNO3已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是Fe2+,则c点和d点参加反应的铁的物质的量之比是 。
科学研究表明,月球上有丰富的He资源,可开发利用作未来的新型能源。
(1)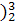 He的中子数是
He的中子数是 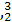 He与
He与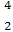 He互称为 。
He互称为 。
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有 个质子和 个中子。
(3)在 He
He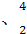 He两种核素中,原子核内的中子数相差为 ,与α粒子有相同质子数和中子数的是 。
He两种核素中,原子核内的中子数相差为 ,与α粒子有相同质子数和中子数的是 。