A、B、C、D均为短周期元素,A和B同周期且相邻,A和C同主族且相邻,三种元素的原子序数之和为31。D元素与A、B、C既不同周期也不同主族。试回答:
(1)元素符号A________ B________D________。
(2)A、B、D可以组成为D4B2A3的离子化合物,该离子化合物的化学式为_______________,B、D形成化合物的分子式为________,分子的空间构型为_________,已知该化合物液态时可以发生电离,当向其中加入金属钠时,生成一种钠盐,同时放出一种可燃性气体,试写出少量该钠盐与水的反应方程式 。
为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)上述实验中第⑤步操作需要烧杯、____________、___________等玻璃仪器。
(2)判断BaCl2已过量的方法是 。
(3)第④步中所有相关的化学方程式是 、 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
共现有m g某气体,它由双原子分子构成,它的摩尔质量为M g / mol。若阿伏加德罗常数的值用NA表示,则:(注意填写单位)
(1)该气体的物质的量为______________。
(2)该气体所含原子总数为________________。
(3)该气体在标准状况下的体积为__________________。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_ ______ __。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为 。
A.[物质结构与性质]
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药。
(1)Ni2+基态核外电子排布式为 。
(2)ClO4-的空间构型是 ;与ClO4-互为等电子体的一种分子为 (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为 ;1molCO(N2H3)2分子中含有σ键数目为 。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a∶b∶c= 。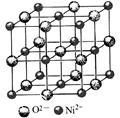
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为____________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
① 反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=____________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为__________________。
③ 据图分析,下列说法正确的是___________ (填字母)。
a. 温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b. 温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c. Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3) FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式: 。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下: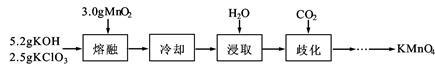
(1)熔融时需用铁坩埚和铁制搅拌棒而不能用玻璃仪器,其原因是 。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为 。
(3)几种物质的溶解度曲线如图所示。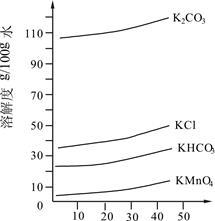
①歧化时,通入CO2至pH为10~11,K2MnO4绿色溶液转化为KMnO4和MnO2。其反应的离子方程式为 。
②歧化时不能通入过量CO2的原因是 。
③通入CO2后,用玻璃棒蘸取溶液点于滤纸上,观察到 ,证明歧化反应已发生。
④歧化后得到KMnO4晶体的操作依次为过滤、 、 及干燥。
(4)在此实验流程中可循环使用的物质的化学式为 。