A.[物质结构与性质]
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药。
(1)Ni2+基态核外电子排布式为 。
(2)ClO4-的空间构型是 ;与ClO4-互为等电子体的一种分子为 (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为 ;1molCO(N2H3)2分子中含有σ键数目为 。
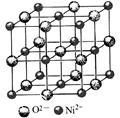
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a∶b∶c= 。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)下列元素的名称: A B C D
(2)写出AB2与足量氢氧化钠溶液反应的离子方程式。
(3)画出D的原子结构示意图, 用电子式表示化合物 C2D 的形成过程。
元素A的原子的L层比M层多6个电子,元素B的L层比K层多5个电子,则A的元素符号为,B的原子结构示意图是,A和B两元素形成的化合物的电子式是,它们形成的化合物中含有的化学键类型为___ ___(填“离子键”或“共价键”),该化合物属于________化合物(填“离子”或“共价”)。
(1)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应的能量转化是___________________________________。
(2)中和反应都是______热反应,其实质是_______________________________。
现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。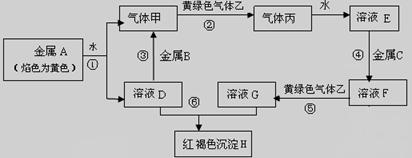
请回答下列问题:
⑴写出金属B和气体丙的化学式、。
⑵写出反应①的化学反应方程式。
⑶写出反应⑥的离子方程式。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑧七种元素在周期表中的位置。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
⑧ |
|||||
| 3 |
① |
③ |
④ |
⑦ |
||||
| 4 |
② |
请回答:(1)画出③的原子结构示意图。
(2)在①、②、③三种元素的最高价氧化物对应水化物中,碱性最强的是(填化学式)。
(3)⑦、⑧两元素对应形成的氢化物中,最稳定的是(填化学式)。
(4)写出⑤和⑥形成的三原子化合物的电子式。
(5)写出①、④元素的最高价氧化物对应水化物之间反应的离子方程式:。