工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) =" Si(s)+4HCl(g) "  mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
下列电离方程式的书写,正确的是
A.Ca(OH)2 Ca2+ + OH2- Ca2+ + OH2- |
B.FeSO4 Fe2+ + S6+ + 4 O2- Fe2+ + S6+ + 4 O2- |
C.H2SO4 H+ + SO4- H+ + SO4- |
D.NaHSO4 Na++ H++ SO42- Na++ H++ SO42- |
下列化学反应中,属于化合反应,但不属于氧化还原反应的是
A.2 CO+O2 2 CO2 2 CO2 |
B.Na2O+H2O 2NaOH 2NaOH |
C.2 H2O 2 H2↑+ O2↑ 2 H2↑+ O2↑ |
D.2 H2O + 2 Na2O2 4 NaOH + O2↑ 4 NaOH + O2↑ |
下列说法中正确的是
| A.蒸馏实验中为了温度测量准确,温度计的水银球应伸入液面以下 |
| B.在标准状况下,1mol NH3和CO混合气体所占的体积约为22.4L |
| C.选择CCl4将碘水中的碘萃取出来,下层无色,上层紫红色 |
| D.装运浓硫酸的包装箱应贴的图标为(如图) |

在酸性的无色透明溶液中能大量共存的离子组是
| A.K+、Ag+、NO3-、Cl- | B.Cu2+、Na+、NO3-、SO42- |
| C.K+、Na+、CO32-、Cl- | D.Mg2+、Na+、NO3-、SO42- |
观察能力是学习化学的一种非常重要的能力。请仔细观察下列各图,正确的是: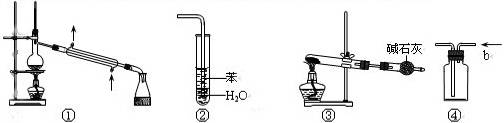
| A.装置①常用于分离互相溶解但沸点不同的液体混合物 |
| B.装置②可用于吸收HCl(极易溶于水)气体,并防止倒吸 |
| C.以NaHCO3为原料,装置③可用于实验室制备少量CO2 [信息提示:2NaHCO3=Na2CO3+CO2↑+H2O,碱石灰为烧碱与生石灰的混合物] |
| D.装置④中,b口进气可收集CO2、NO等气体 |