有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答: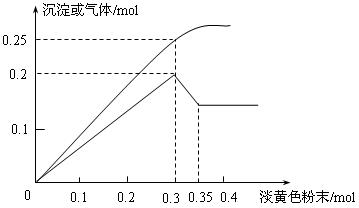
(1)淡黄色粉末为_____________(填名称),溶液中肯定没有____________离子。
(2)溶液中存在的各溶质阳离子的物质的量分别是_________________________。
(3)当加入0.3mol淡黄色粉末时,生成气体成分是 , 物质的量之比是 。
(4)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为__________________________________。
一个密闭容器,中间有一可自由滑动的隔板(厚度或忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共9g时,隔板处于如图位置(左、右两侧温度相同),求混合气体中CO和CO2的分子个数比。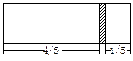
我国规定食盐的含碘量(按每千克食盐含碘元素计)为20mg·kg-1~40mg·kg-1,则每千克食盐加入碘酸钾(KIO3)的物质的量应不少于。
100mL0.3mol/LNa2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为_______.
实验欲配制6.00 mol/L的H2SO4溶液.现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸;②150 mL 25.0%的硫酸(ρ=1.18 g/mL);③足量的18.00 mol/L的浓H2SO4.现有三种规格容量瓶:250 mL、500 mL、1000 mL.配制要求:①、②两种硫酸全部用完,不足部分由③补充.试回答:
(1)选用容量瓶的规格是。
(2)需要18.0 mol·L-1 H2SO4(aq)的体积是。
氢气和氧气的混合气体,在120℃和一定压强下体积为a升,点燃后发生反应.待恢复至原来温度和压强时,测得其体积为b升.原混合气体中氢气和氧气的体积各是多少升?