在下列强酸性溶液中,能大量共存的是
| A.Ca2+、K+、HCO3—、OH— | B.Na+、ClO—、H+、MnO4— |
| C.Fe3+、Mg2+、Cl—、SCN— | D.K+、NH4+、SO42—、Cl— |
下列叙述不正确的是:
| A.液氯泄漏事故时,附近人员应迅速远离液氯泄漏地点,并逆风往安全区域疏散 |
| B.水的沸点比硫化氢高,主要原因是水分子间能形成氢键 |
| C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 |
| D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应 |
在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右。在漫漫加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是:
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4- |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是:
A.密闭容器中CuO和C高温反应的气体产物: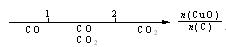 |
B.Fe在Cl2中的燃烧产物: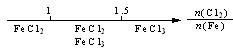 |
C.AlCl3溶液中滴加NaOH后铝的存在形式: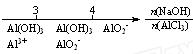 |
D.氨水与SO2反应后溶液中的铵盐: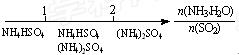 |
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4 溶于100ml水中
②将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100  ml
ml
③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和 称取的NaCl质量分别是
称取的NaCl质量分别是
| A.950mL,111.2g | B.500mL,117g |
| C.1000mL,117g | D.任意规格,111.2g |