元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同.若相同条件下,A气球放在CO中静止不动,B气球放在O2中上浮.下列叙述或表示正确的是()
| A.X气体的相对分子质量比Y气体的相对分子质量大 |
| B.X可能是N2,Y可能是CH4 |
| C.X气体的密度小于Y气体的密度 |
| D.充气后A气球质量比B气球质量大 |
将0.1mol·L-1K2SO4溶液、0.2mol·L-1Fe2(SO4)3溶液与水混合,欲使混合溶液中K+、Fe3+、SO42-物质的量浓度为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1,则所用的K2SO4溶液,Fe2(SO4)3溶液、水的体积比约为()
| A.1:1:1 | B.2:1:1 | C.1:1:2 | D.2:1:2 |
下列说法不正确的是( )
| A.5.85gNaCl晶体溶于100g水,所得溶液物质的量浓度不等于1mol/L |
| B.20g浓度为c mol·L-1的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积小于20ml |
| C.某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-的物质的量约等于1.50 mol |
D.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为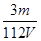 mol·L-1 mol·L-1 |
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O–2e-→SO42-+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为( )
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
已知mg气体A和ng气体B所含分子数相等,下列说法不正确的是 ( )
| A.标准状况下,相同体积的气体A和气体B的质量之比为m:n |
| B.25oC时,相同质量的气体A和气体B的分子数之比为n:m |
| C.同温、同压时,气体A和气体B的密度之比为n:m |
| D.通常状况下,相同质量的气体A和气体B的体积之比为n:m |