电池是人类生产和生活中重要的能量来源。各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
下列措施对增大反应速率明显有效的是()
| A.将煤块磨成煤粉在“沸腾炉”中燃烧 |
| B.Na与水反应时增大水的用量 |
| C.FeCl3和NaOH两溶液反应时,增大压强 |
| D.Fe与稀硫酸反应制取H2时,改为98%的浓硫酸 |
下列有关化学用语使用正确的是()
A.NH4Br的电子式: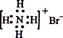 |
B.CO2的结构式: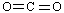 |
| C.乙酸的分子式: CH3COOH | D.乙烯的结构简式:CH2CH2 |
下列化工生产原理错误的是()
①可以用电解熔融的氯化钠的方法来制取金属钠②可以用钠加入氯化镁饱和溶液中制取镁③用电解法制铝时,原料是氯化铝④炼铁高炉中所发生的反应都是放热的,故无需加热
| A.②③ | B.①③ | C.①②③ | D.②③④ |
工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,则从经济效益考虑最合理的反应是( )
A.C3H8 3C+4H2 3C+4H2 |
B.C3H8 C3H6+4H2 C3H6+4H2 |
C.C3H8+6H2O 3CO2+10H2 3CO2+10H2 |
D. |
下列化学式只代表一种物质的是()
| A.C5H12 | B.C4H10 | C.C2H6O | D.C2H4 |