已知A、B、C、D、E、F是短周期中的6种非金属元素,它们的原子序数依次增大。A元素是周期表中半径最小的元素, B原子的最外层上有4个电子;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y;F的L层电子数等于K、M两个电子层上电子数之和
(1)请写出元素符号:
A B C D E F
(2)画出F的阴离子的结构示意图
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为
向X的水溶液中滴入酚酞溶液,会观察到
(4)写出E在D的单质中点燃,生成固体Y化学方程式 
(5)将12gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是 。(相对原子质量:C—12)
(3分)近来研究认为松果体分泌物——“退黑素”(英文名称melatonin,简称MLT)与人的寿命长短有关、有人把“退黑素”和克隆技术并称为“二十世纪生命科学的两大发现”。退黑素的化学结构简式为: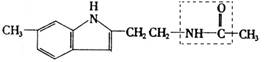
(1)退黑素的分子式为
(2)退黑素结构简式中,虚线框内的结构名称为,它在稀硫酸中受热后生成的具有酸性的物质的最简式为。
(8分)已知乳酸的结构简式为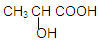 ,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
(1)写出乳酸发生下列反应的化学方程式
①与足量的金属钠反应________________________________________
②与少量的碳酸钠反应 _______________________________________
(2)由乳酸的组成和结构推断还可能发生的哪些类型的反应,写出两种反应类型:。
有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20;只有C、E是金属元素;A和E元素原子的最外层电子都只有一个;B和D 元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;C元素原子的最外层电子数是D元素原子最外层电子数的一半。由此可知:
(1)C在元素周期表中的位置是______________________。
(2)D元素最高价氧化物对应水化物的分子式为,形成E元素最高价氧化物对应水化物的化学键类型____________________。
(3)D与E形成的化合物属于(填“离子化合物”或“共价化合物”)。
(4)写出C与NaOH溶液反应的离子方程式:________________________.
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_________________,原因是。
(2)哪一段时段的反应速率最小,原因是。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,直接写计算结果)。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)。
天然气是一种洁净环保的优质能源,天然气主要成分是烷烃,其中甲烷占绝大多数。
(1)甲烷分子具有____________结构,其结构式是___________。
(2)天然气是一种高效、低耗、污染小的清洁能源,已知1mol甲烷完全燃烧生成CO2气体和水蒸气放出802KJ热量,则在相同条件下,1mol甲烷完全燃烧生成CO2气体和液态水,放出的热量________802KJ(填“>”、“=”或“<”)。
(3)通常情况下,甲烷比较稳定,但在特定条件下,甲烷也会发生某些反应,请写出甲烷在光照条件下与氯气反应生成一氯甲烷的化学方程式__________________该反应属于______________(填反应类型)。
(4)在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图: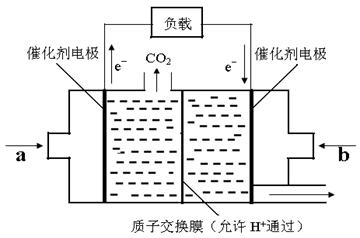
若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;该电池工作过程中,H+的移动方向为从_____到_____(填“左”或“右”)。