氯碱工业中电解饱和食盐水的原理示意图如下图所示

(1)溶液
的溶质是;
(2)电解饱和食盐水的离子方程式是
(3)电解时用盐酸控制阳极区溶液的
在2~3,用化学平衡移动原理解释盐酸的作用
(4)电解所用的盐水需精制。去除有影响的
、
,
,
,[
]。
精致流程如下(淡盐水和溶液
来电解池):

①盐泥
除泥沙外,还含有的物质是。
②过程Ⅰ中将
转化为
的离子方程式是
③
的溶解度比
的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中
中剩余
的含量小于5
,若盐水
中
的含量是7.45
,则处理10
盐水
,至多添加10%
溶液
(溶液体积变化忽略不计)。
23.(10分)下表是某超市出售的加碘食盐的有关说明:
| 精制盐、碘酸钾 |
|
| 含碘量 |
45±5mg/kg |
| 储藏方法 |
通风、防潮 |
| 食用方法 |
根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200 mL蒸馏水中加入75.0g该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在下图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。请你设计实验方案验证乙同学的假设是否正确:。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
| 物质 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe(OH)3 |
2.2 |
3.2 |
| Fe(OH)2 |
7.6 |
9.6 |
| Cu(OH)2 |
4.7 |
6.4 |
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的(填代号)。
a. Na2O2 b. H2O2 c. Cl2 d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。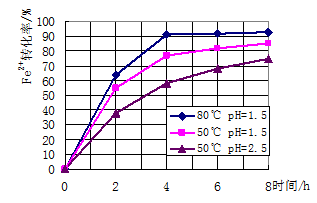
(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为。
(16分) 乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精。天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成。下图是一种合成路线(部分反应物和条件省略)。
已知A是一种不饱和烃,B、C、D都为含碳原子数相同的常见有机物。请回答:
(1)乙酸苯乙酯(H)的分子式为,F的结构简式为___________________;
(2)A→B属于反应,F→G属于反应;
(3)对图中有关化合物的叙述中正确的是;(填序号)
①化合物C不能发生银镜反应②化合物G属于醇类
③E、F、G都属于芳香烃④化合物D所含官能团为羧基
(4)写出D + G → H 的化学方程式:
(5)M是H的一种同系物,取1mol M完全燃烧可消耗9 mol O2,试写出苯环上只有一个支链的M的所有同分异构体的结构简式:
、、。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:①C3H8(g) = CH4(g)+HC≡CH(g)+H2(g);△H1=156.6kJ·mol-1
②CH3CH=CH2(g) = CH4(g)+HC≡CH(g) ;△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g) = CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3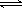 HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”)。
.现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层电子数比K层电子数多4个 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T位于元素周期表的第______周期第_____族。写出T2-的原子结构示意图______________。
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
。
(3)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是(填化学式)。