孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
| 物质 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe(OH)3 |
2.2 |
3.2 |
| Fe(OH)2 |
7.6 |
9.6 |
| Cu(OH)2 |
4.7 |
6.4 |
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的 (填代号)。
a. Na2O2 b. H2O2 c. Cl2 d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。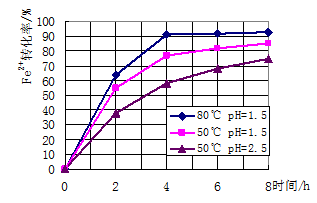
(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为 。
19.PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为: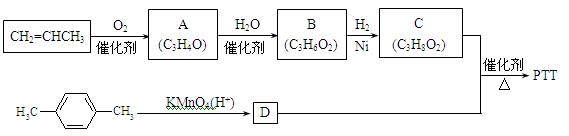
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为,B的结构简式为。
(2)由物质C与D反应生成PTT的化学方程式为,反应类型为。
(3)分子式为C4H6O与A互为同系物的同分异构体有种,写出其中一种物质的结构简式。
(4)请补充完整下列以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。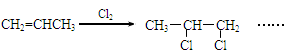
33.(12分)
(1)向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g) 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。平衡后继续向容器中充入惰性气体,平衡_________移动。(填“正向”,“逆向”,“不”)
(2)用A表示2分钟内平均反应速率,
A在第1分钟平均速率第2分钟平均速率(填“<”、“>”、“=”)。
(3)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(4)为了增大B的转化率,可采取的措施是_________(用序号填空)
①加入A
②加入B
③加压
④再加入1.6 mol A+ 0.8 mol B
⑤将C分离出容器
(5)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B
②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D
④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D
32.
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol-1.请回答下列问题: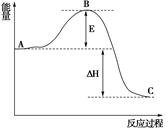
①图中E、C分别表示、,
②E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是
③图中△H=kJ·mol-1。
31.B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂。并能进行如图所示的反应。且D能发生加聚反应。
(1)写出A的结构简式
(2)下列反应的化学方程式和反应类型
反应②:;
(3)写出A与足量的溴水反应的方程式且命名产物:;
(4)写出D在一定条件下发生加聚反应的化学反应方程式:
24.(12分)根据下列变化关系:
已知:E是一种具有果香味、难溶于水的物质,请填空:
(1)A物质的名称____________________。B溶液为__________________________.作用为__________________________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ _______________________________________________________ ()
⑥_________________________________________________________ ()