33.(12分)
(1)向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g) 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。平衡后继续向容器中充入惰性气体,平衡_________移动。(填“正向”,“逆向”,“不”)
(2)用A表示2分钟内平均反应速率 ,
A在第1分钟平均速率 第2分钟平均速率(填“<”、“>”、“=”)。
(3)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(4)为了增大B的转化率,可采取的措施是_________(用序号填空)
①加入A
②加入B
③加压
④再加入1.6 mol A+ 0.8 mol B
⑤将C分离出容器
(5)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B
②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D
④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D
(1)下列各组化合物中,属于同系物的是(填入编号),属于同分异构体的是(填入编号)。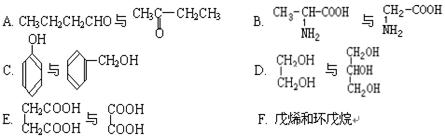
(2)有机物A: 在加热条件下和Br2 按物质的量之比1:1发生的非邻位碳的加成反应方程式 。
在加热条件下和Br2 按物质的量之比1:1发生的非邻位碳的加成反应方程式 。
(3)某高分子有机物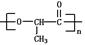 是由一种单体缩聚而成的,该单体的结构简式为。
是由一种单体缩聚而成的,该单体的结构简式为。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子; B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为,B为,C为,D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: _______________。
(3)A、B两元素形成化合物属 (“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: ________。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B,C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:。
(3)写出A、B两元素最高价氧化物的水化物反应的离子方程式:。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,金属性最强的元素是
(2)化学性质最不活泼的元素其原子结构示意图为;
(3)元素的最高价氧化物对应的水化物中酸性最强的是,碱性最强的是,呈两性的氢氧化物是;
(4)在③~⑦元素中,原子半径最大的是,原子半径最小的是;
(5)在⑦与⑩的单质中,化学性质较活泼的是,可用什么化学反应说明该事实(写出反应的化学方程式):。
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下: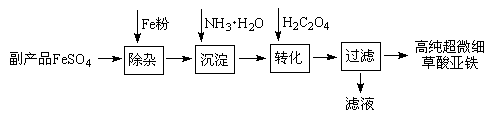
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有。
(2)滤液经处理可得到副产品。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为。(写出计算过程)
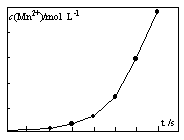
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为。