(1)根据下列几种粒子的结构示意图,回答问题: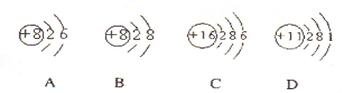
①其中属于阴离子的是 ,属于金属元素的是 。(填编号)
②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式: 。
(2)已知氢元素有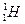 、
、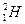 、
、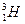 三种核素,氧
三种核素,氧 元素也有
元素也有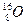 、
、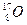 、
、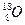 三种核素,则它们所形成的水分子共有 种。
三种核素,则它们所形成的水分子共有 种。
(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下: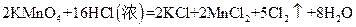
①在该反应中,氧化剂是 ,还原剂是 。
②当有0.20 mol电子发生转移时,生成氯气的体积为 L(标准状况)
298K时,合成氨反应的反应热△H=-92.4 kJ·mol-1。在该温度下,取1mol N2和3molH2放在一个密闭的容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_______________。
写出下列反应的热化学方程式。
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量_______________________________
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ___________________________
某课外兴趣小组对H2O2的分解速率做了如下实验探究。下表是该小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10 mL H2O2制取150 mL O2所需的时间(秒)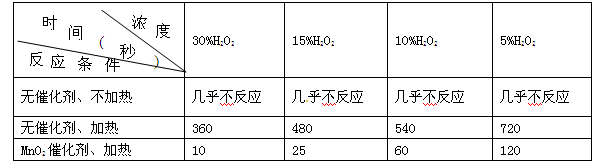
(1)该研究小组在设计方案时,考虑了浓度、____________、____________等因素对过氧化氢分解速率的影响;
(2)若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89 kJ能量,写出该反应的热化学方程式:____________________;
(3)产生的O2充入某密闭容器,发生4NH3(g)+5O2(g) 4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
| A.υ(NH3)="0.4" mol / (L·s) |
| B.υ(O2)="0.5" mol / (L·s) |
| C.υ(NO)="0.6" mol / (L·s) |
| D.υ(H2O)="1" mol / (L·min) |
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;
在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1∶1或2∶1形成化合物,但常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态,D的原子最外层电子数最多,E的核电荷数最大,D与E组成的ED4常温下为气态。
(1)画出D的原子结构示意图____,五种元素原子半径从大到小的顺序是____ (填元素符号);
(2)写出A与B可以形成2种化合物的结构式为____,____;
(3)由C与B原子形成的2种化合物的电子式分别是____、____;
(4)D、E所形成氢化物的稳定性由强到弱的顺序是____ (填具体的化学式);
(5)由短周期元素组成的某些微粒,原子总数相同、价电子总数相同的分子(或离子)如SO2、O3、NO,可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N、CS2互称为等电子体的微粒是____,____ (填符合要求2种微粒的名称);
(6)写出工业上制E单质的化学方程式: ____。