化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其化学式为Na2CaSi6O14,以氧化物形式可表示为_________;铝制品表面因有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏。若将氧化铝与氢氧化钠溶液作用,反应的离子方程式为_______________________。
(2)氯气用于漂白时,实际上起漂白作用的物质不是Cl2而是它和水反应生成的__________(写化学式)。缺铁性贫血患者补充的铁,通常以硫酸亚铁的形式;而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是___________。
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是__________(填选项字母)。
| A.铜和浓硫酸反应 | B.铜和稀硫酸反应 |
| C.氧化铜和硫酸反应 | D.铜与Fe(SO4)3溶液反应 |
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。回答问题:
(1)D元素的名称为,F形成的离子的结构示意图为。
(2)写出液态化合物Y的一种用途。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式,使用这种气球存在的隐患是。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为。
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 |
信息 |
| B |
其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D |
其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E |
元素原子最外层比次外层少2个电子 |
| C、F |
两种元素的原子最外层共有13个电子 |
则:(1)B的原子结构示意图为。
(2)B、C、E分别与A形成的化合物中最稳定的是(写化学式)。
(3)C与D形成的化合物的化学式是,它的性质决定了它在物质的分类中应属于;请写出该化合物对应水化物电离的方程式。
(4)F的单质在反应中常作剂,该单质的水溶液与E的低价氧化物反应的离子方程式。
现有下列9种微粒: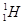 、
、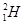 、
、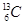 、
、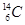 、
、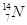 、
、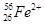 、
、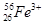 、
、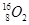 、
、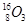 。按要求完成以下各题:
。按要求完成以下各题:
(1) 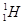 、
、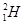 、
、 分别是氢元素的一种,它们互称为。
分别是氢元素的一种,它们互称为。
(2)互为同素异形体的微粒是。
(3)对于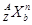 ,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
①Z、n、b相同而A不同:;
②A、n、b相同而Z不同:;
③A、Z、b相同而n不同:;
④Z、n、A相同而b不同:。
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至后,迅速关闭K1,观察到U形管内的现象是。
②装置Ⅲ中发生反应的化学方程式为。
③蘸NaOH溶液的棉花团的作用是。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO。
某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。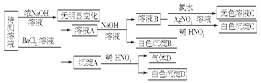
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| 肯定存在的离子 |
肯定没有的离子 |
沉淀D |
||
| 化学式或离子符号 |
||||
(2)待测溶液中是否有SO32-、SO42-。若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为,形成沉淀B时反应的离子方程式为。
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是。