1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖。氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途。
Ⅰ.以氨为原料,合成尿素的反应原理为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH =" a" kJ/mol。
CO(NH2)2(l)+H2O(g) ΔH =" a" kJ/mol。
为研究平衡时CO2的转化率与反应物投料比( )及温度的关系,研究小组在10 L恒容密闭容器中进行模拟反应,并绘出下图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
)及温度的关系,研究小组在10 L恒容密闭容器中进行模拟反应,并绘出下图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。

(1)a 0 (填“>”或“<”),判断依据是__________________。
(2)①投料比:Ⅰ Ⅱ(填“>”或“<”)。
②若n(CO2)起始="10" mol,曲线Ⅱ的投料比为0.4,在100℃条件下发生反应,达平衡至A点,则A点与起始压强比为_________________。
③A点平衡常数与B点平衡常数间的关系:KA KB (填“>”或“<”或“=”)。B点正反应速率与C点正反应速率间的关系为:v (B)_________v (C) (填“>”或“<”或“=”)。
(3)若按曲线Ⅰ的投料比投料,在上述实验中压缩容器体积至5L,在上图中画出反应达平衡时的二氧化碳的转化率与温度之间的关系曲线。
(4)为提高CO2转化率可以采取的措施是 。
a.使用催化剂
b.及时从体系中分离出部分CO(NH2)2
c.将体系中的水蒸气液化分离
Ⅱ.氨气可用于工业上生产硝酸,其尾气中的NO2可用氨水吸收生成硝酸铵,25℃时,将10molNH4NO3溶于水,溶液显酸性,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将_________(填“正向”、“逆向”或“不”) 移动, 此中性溶液中NH3·H2O的物质的量为________mol。(25℃时,NH3·H2O的电离平衡常数Kb=2×10-5)
铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为 。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
①步骤I中反应温度不宜过高的原因是 ,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为 。
②步骤Ⅱ中物质X可选用 (填字母),该物质需过量的原因,其一是加快反应速率,其二是 。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为 ,若有3mol FeS2参加反应,转移电子数为 .
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2, 该反应的离子方程式为 。
(2)氢氧化铁与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(3)从海带中提取碘的过程中,下列说法正确的是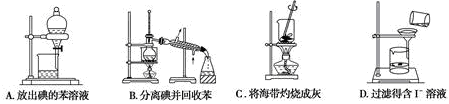
化学与人类社会可持续发展密切相关,能源、环境、工业生产以及日常生活等都离不开化学。
(1)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式________________________;国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式_______________________。
(2)氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________。实验室可利用如右图所示装置完成该反应,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是____________________。
(3)三硅酸镁(Mg2Si2O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________。将0.184 g三硅酸镁加到50 mL 0.1 mo1·L-1盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用 0.1 mo1·L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O的n值为____________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
回答下列问题: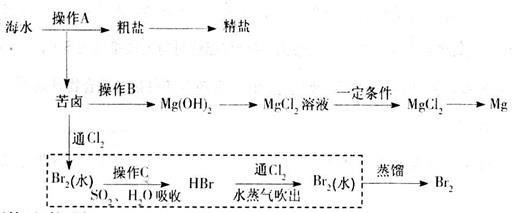
(1)操作A是______________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是__________________。
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是_________(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)操作C是______________;上图中虚线框内流程的主要作用是_________________。
(4)上图中虚线框内流程也可用 Br2与Na2CO3,反应的化学方程式补充完整:
Br2与Na2CO3,反应的化学方程式补充完整:
(5)已知苦卤的主要成分如下:
理论上,1 L苦卤最多可得到Mg(OH)2的质量为________g。