【化学—选修2:化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(l)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技又分为 。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为
(2)煤在燃烧前后及燃烧过程中均可采取措施减少有害气体的排放
①在燃烧前,可以采用微生物脱硫技术。原理如图所示:
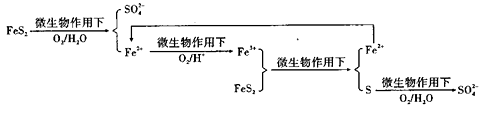
图示过程中Fe2+的作用为 写出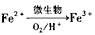 的离子方程式:
的离子方程式:
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,再把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入
设备,用石灰水淋洗。
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且有成单电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式。
(2)A的单质分子中 键的个数为。
键的个数为。
(3)A、B、C三种元素第一电离能由大到小的顺序为(用元素符号表示)
(4)B元素的氢化物的沸点是同族元素中最高的,原因是。
(5)A的最简单氢化物分子的空间构型为,其中A原子的杂化类型是。
(6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为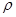 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=cm. (用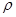 、NA的计算式表示)
、NA的计算式表示)
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式A.,B.
(2)实验室提纯粗盐的实验操作依次为:取样、、沉淀、、、冷却结晶、、烘干
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是.碳酸化时没有析出碳酸钠晶体,其原因是
(4)碳酸化后过滤、滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方式程为,滤液D加石灰水前先要加热,原因是
(6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(注明你的表达式中所用的有关符号的含义)
(1)、①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,其很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施):。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e →2O2-)
①c电极为,d电极上的电极反应式为。
②图乙是电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为。若a电极产生56mL(标准状况)气体,则所得溶液的pH=(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入(选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(1)请完成该反应的离子方程式:
C +MnO4- +H+ — CO2↑+Mn2+ +H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K=。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为mol/L 。(已知25℃时Ksp[Fe(OH)3]=4×10-38)
氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图: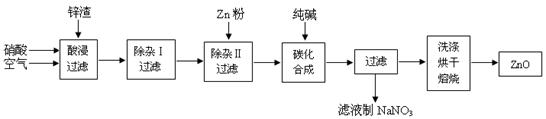
有关氢氧化物沉淀完全的pH见下表: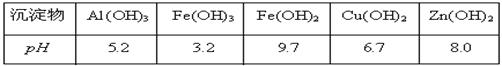
(1)在酸浸过程中,常将锌渣碎成粉末并通入空气,同时保持酸过量,理由是。
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是,KMnO4是该反应的(氧化剂、还原剂)。将溶液的pH调至4,目的是。
②在“除杂II”中,加入锌粉的目的是。
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式。
(5)本工艺中,过滤分离次数较多,其明显的缺陷是。