铁是目前人类使用量最大的金属,它能形成多种化合物.
(l)工业上,向炽热铁屑中通入氯化氢可生成无水氯化亚铁,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3,常用的试剂是 ;为防止FeC12溶液中含有FeCl3,最好在FeCl2溶液中加入
(2)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,同时伴随产生一种可燃性气体,该反应的化学方程式为 。若有1mol C参与反应,则转移的电子数目为
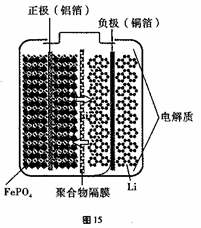
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开,只允许锂离子通过)工作原理为FePO4+Li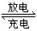 LiFePO4。如图所示,则放电时FePO4一端为电池的 极,充电时阳极上的电极反应式为______________________________。
LiFePO4。如图所示,则放电时FePO4一端为电池的 极,充电时阳极上的电极反应式为______________________________。
(3)硫化亚铁常用于工业废水的处理。已知25℃时,溶度积常数Ksp[FeS]=6.3×10-18,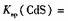 3.6×10-29。请写出用硫化亚铁处理含Cd2十的工业废水的离子方程式:
3.6×10-29。请写出用硫化亚铁处理含Cd2十的工业废水的离子方程式:
在FeS、CdS的悬浊液中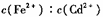 =
=
(4)已知25℃时,尺,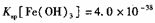 ,此温度下若在实验室中配制
,此温度下若在实验室中配制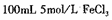 溶液,为使配制过程中不出现浑蚀现象,则至少需要加入 mL 2lnol/L的盐酸〔体积变化忽略不计)
溶液,为使配制过程中不出现浑蚀现象,则至少需要加入 mL 2lnol/L的盐酸〔体积变化忽略不计)
已知2NH3(g)  N2(g) +3 H2(g);在某温度下,在2 L密闭容器中加入一定量的NH3,反应到10分钟时各组分的浓度不再改变,此时测得各组分的浓度如下:
N2(g) +3 H2(g);在某温度下,在2 L密闭容器中加入一定量的NH3,反应到10分钟时各组分的浓度不再改变,此时测得各组分的浓度如下:
| 物质 |
NH3 |
N2 |
H2 |
| 物质的量(mol) |
0. 1 |
0.2 |
0.6 |
该时间内平均反应速率v(N2) =
达到平衡状态后,下列说法正确的是:
a.通过改变反应 条件可使现有平衡移动
条件可使现有平衡移动
b.NH3的分解速率和合成速率相等
c.NH3不再分解了
d.通过改变反应条件可使NH3全部分解成N2和H2
下表为元素周期表的一部分 ,用化学用语回答下列有关问题:
,用化学用语回答下列有关问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)⑧的原子结构示意图为:;
(2)表中某两种元素的原子形成的5核10电子分子是:(写化学式);
(3)③、⑧、⑨的最高价含氧酸的酸性最强的是:(写化学式);
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是(写化学式),它属于(选填“共价化合物”或“离子化合物”)
(5)表中分别位于三个周期的三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的化学式为:
(6)由⑥的单质与某物质反应生成②的单质的化学方程式为:
在实验室中:
(1)烧碱溶液保存时,误用了磨口玻璃塞,一段时间后,瓶塞无法打开。请用化学方程式解释: ;
;
(2)用湿润的淀粉淀粉碘化钾试纸检验氯气,现象是:;
涉及的离子方程式为:。
下面是我们熟悉的物质: ①O2 ②金刚石 ③NaBr ④H2SO4⑤NaOH⑥NH4Cl ⑦Na2O2 ⑧Ne
(1)请用序号填空:这些物质中,只含共价键的是;只含离子键的是;不存在化学键的是;
(2)Na2O2中阴、阳离子数目之比是,NaOH的电子式为。
按要求填空:
(1)写出表示含有8个质子,10个中子的原子的化学符号:。
(2)在 1 1H、 2 1H、 3 1H中共有种原子,它们能形成种氢气分子。
(3)某简单微粒的结构示意图为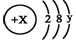 ,且X、Y 均为不大于20的正整数,据此回答下列问题:
,且X、Y 均为不大于20的正整数,据此回答下列问题:
①若呈电中性时该微粒不易与其它物质发生反应,这种微粒的符号是;
②若该微粒为一价阳离子,则x=,该微粒表示的元素位于第周期族。