下面是我们熟悉的物质: ①O2 ②金刚石 ③NaBr ④H2SO4 ⑤NaOH ⑥NH4Cl ⑦Na2O2 ⑧Ne
(1)请用序号填空:这些物质中,只含共价键的是 ;只含离子键的是 ;不存在化学键的是 ;
(2)Na2O2中阴、阳离子数目之比是 ,NaOH的电子式为 。
根据乙烯和乙醇的知识填空。
(1)完成下列化学方程式:CH2= CH2+ CH3CH2OH;
CH3CH2OH;
(2)实验室,乙醇跟乙酸在浓硫酸催化且加热的条件下反应,制取的是。
现有以下四种物质:
| A.新制的氢氧化铜[Cu(OH)2]悬浊液 | B.碳铵(NH4HCO3) |
| C.明矾[ KAI(SO4)2·12H2O] | D.熟石灰[Ca(OH)2] |
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验尿液中是否含有葡萄糖,可使用;
(2)要使含泥沙的洪水变澄清,可使用;
(3)要中和钢铁厂、电镀厂产生的酸性废水,可使用;
(4)给农作物施用氮肥,可使用。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲通入过量CO2后生成沉淀F的离子反应方程式为______________________________________。
(2流程乙加入烧碱溶解SiO2的化学反应方程式____________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途____________________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=12,则此温度下残留在溶液中的c(Mg2+)=________________。
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。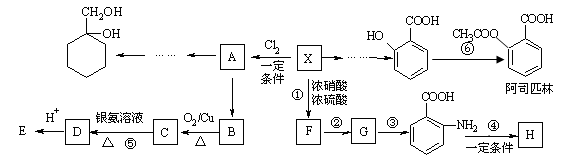
已知:
Ⅰ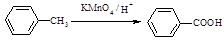
Ⅱ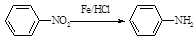 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是______________;(2)反应②的类型是______________;
(3)反应⑤的化学方程式是____________________________________________;
反应⑥的化学方程式是____________________________________________;
(4)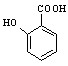 有多种同分异构体,其中符合下列条件的共有__________种
有多种同分异构体,其中符合下列条件的共有__________种
①能发生银镜反应但不能水解
②每摩尔同分异构体最多消耗2mol NaOH
③苯环上一氯代物只有两种
一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: C(s)+CO2(g)  2CO(g) △H>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
2CO(g) △H>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。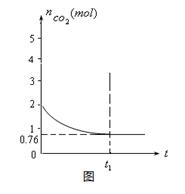
(1)该反应的ΔS0(填“>”、“<”或“=”)。在(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数K。
(结果保留一位小数)
(3)向上述平衡体系中再通入CO2,则CO2的转化率(填增大、减小、不变、无法确定)。
(4)相同温度下,2升的恒容容器乙中加入4moL碳和4moLCO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2升的恒容容器丙中加入4moL碳、4moLCO2和4moLCO。开始反应时
V(正)V(逆)(填>、<、﹦)。