黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
| A.升高温度 | B.降低温度 |
| C.增大压强 | D.减小压强 |
E.加入催化剂 G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更重要的化工原料,反应的化学方程式为
我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3 + KI + H2SO4  K2SO4 + I2 + H2O
K2SO4 + I2 + H2O
(1)将上面氧化还原反应的化学方程式配平。
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为
(4)若要提取生成的碘,所用的萃取剂可以是 (填序号)。
①水②酒精③淀粉溶液④苯
(5)加碘食盐不能长时间炖炒,且应避热保存,主要原因是 。
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
2015年巴黎气候变化大会的主题之一是节能减排,开发新能源以及提高能源的利用率再次受到国际社会的高度关注。
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是________(填字母)。
A、氢能 B、天然气 C、石油
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-l
2C(s)+O2(g)=2COg) △H=-221.0 kJ·mol-l
2CO(g)+O2(g)=2CO(g) △H=-556.0 kJ·mol-l
请回答下列问题:
①l g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为______________kJ。
氢气被称为绿色能源的主要原因是____________________。
②若18 g C(s)氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,
则该过程放出的热量比等质量的C(s)在氧气中完全燃烧时要少______________kJ。
③将煤转化为水煤气(H2、CO的混合气)是将煤转化为清洁燃料的方法之一。
则C(s)与H2O (g)反应制备水煤气的热化学方程式为__________________________。
(3)工业上可通过CO(g)和H2(g)化合来制备可再生能源CH3OH(g):
CO(g)+2H2(g)=CH3OH(g) △H=-99 kJ·mol-l
又知该反应中某些物质分子里的化学键的键能数据如下表: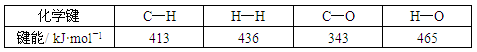
如CO中的C与O之间为叁键连接,则C≡O键的键能为___________kJ·mol-l。
某有机化合物A广泛存在于多种水果中。
(1)经测定,A中仅含有C、H、O三种元素,67 gA在空气中完全燃烧时可生成27g H2O和88 g CO2。则A的实验式或最简式为________________。
若要确定A的分子式,还需要知道A的相对分子质量,测定物质的相对分子质量可以采用___________(填“质谱”或“红外光谱”)法。
经测定A的相对分子质量为134,则A的分子式为_______________。
(2)又知1 molA与足量的NaHCO3溶液充分反应可生成标准状况下的C02气体44.8 L,
l molA与足量的Na反应可生成1.5 mol的H2,则A分子中所含官能团的名称为_________。
(3)若A分子中不存在甲基且有一个手性碳原子,则A的结构简式为________________。
该A在浓硫酸存在下加热,可以生成多种产物,请写出A发生消去反应后所得有机产物的结构简式________________。
(4)A的一种同分异构体B,与A所含官能团的种类和数目均相同,且能催化氧化成醛,则B的1H核磁共振谱图中将会出现__________组特征峰。
合理使用药物是保证身心健康、提高生活质量的有效手段。药物化学已经成为化学的一个重要领域。
(1)我国科学家屠呦呦因发现治疗疟疾的特效药——青蒿素,而获得2015年诺贝尔生理学或医学奖。青蒿素的结构简式如右图所示,其含有的过氧基(—O—O—)具有强氧化性。
请回答下列问题:
①青蒿素的分子式为_______________________。
②下列有关青蒿素的叙述中,正确的是__________(填字母)。
A、青蒿素属于芳香族化合物
B、青蒿素具有强氧化性,可用于杀菌
C、青蒿素分子中的所有碳原子在同一个平面上
D、在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸) 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
请回答下列问题:
①乙酰水杨酸中的含氧官能园的名称为____________________。
②制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是________________(填字母)。
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
③写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式:_____________。
④1 mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为_________mol。