Ⅰ、北京时间11月1日清晨5时58分07秒,中国“ 长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ·mol-1
C(S)+O2(g)=CO2(g);ΔH=–393.5kJ·mol-1[来
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量 的H2、C、CH
的H2、C、CH 4完全燃烧时放出热量最多的是 。
4完全燃烧时放出热量最多的是 。
⑵根据以上反应,则C(S)+2H2(g)=CH4(g)的焓变ΔH= 。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
。
Ⅱ、据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解 金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是 。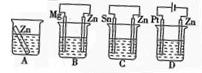
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。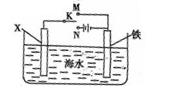
海水的综合利用可以制备金属镁,其流程如下图所示: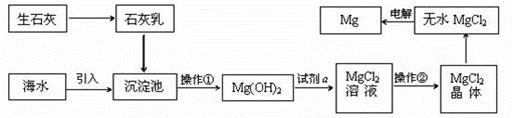
提示:①MgCl2晶体的化学式为MgCl2·6H2O;
②MgO的熔点为2852oC,无水MgCl2的熔点为714oC。
(1)操作②的名称是________、________、过滤。
(2)试剂a的名称是_______________________。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤_____________________________
_________________________________________________________________________。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_______________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明下列情况下使用玻璃棒的目的;
过滤时:__________________________、蒸发时:________________________
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
分某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了一系列实验,实验结果记录如下: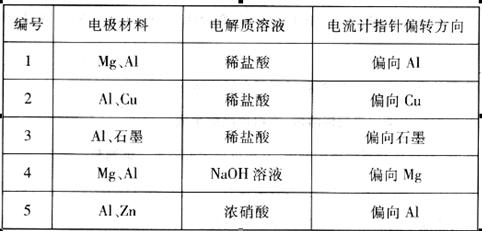
请根据上表中的实验记录回答下列问题:
(1)实验1、2中的Al所作的电极是否相同?____________________。
(2)在实验3中,Al作__________极,电极反应式为___________,电池总反应式为__________。
(3)实验4中的Al作正极还是负极?____________________,原因是____________________。
(4)解释实验5中电流计指针偏向Al的原因:__________________。
(5)根据实验结果,总结在原电池中金属铝作正极还是负极受到哪些因素的影响?____________________。
分在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止。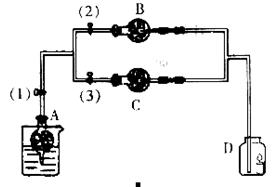
(1)装置B的淡黄色粉末是____________,干燥管C中的白色固体应为_____________,
(2)A中发生反应的离子方程式为____________,
(3)B中发生的化学反应方程式为____________。