(16分) 乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精。天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成。下图是一种合成路线(部分反应物和条件省略)。
已知A是一种不饱和烃,B、C、D都为含碳原子数相同的常见有机物。请回答:
(1)乙酸苯乙酯(H)的分子式为 ,F的结构简式为___________________;
(2)A→B属于 反应,F→G属于 反应;
(3)对图中有关化合物的叙述中正确的是 ;(填序号)
①化合物C不能发生银镜反应 ②化合物G属于醇类
③E、F、G都属于芳香烃 ④化合物D所含官能团为羧基
(4)写出D + G → H 的化学方程式:
(5)M是H的一种同系物,取1mol M完全燃烧可消耗9 mol O2,试写出苯环上只有一个支链的M的所有同分异构体的结构简式:
、 、 。
A、B、C、D四种化合物的焰色反应均为黄色;C、D与盐酸生成一种无色无味气体E,该气体能使澄清石灰水变浑浊;D和A可反应生成C;B和E反应可生成C和另一种无色无味气体F。请回答下列问题:
(1)写出E、F的化学式:E,F。
(2)写出B和E反应的化学方程式:。
(3)写出D和A反应的离子方程式:。
铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
下列两组混合物,括号内为杂质,填写除去杂质所需试剂或方法,并写出反应的化学方程式。(请按相应序号填在答题卷上)
| 混合物 |
试剂或方法 |
化学方程式 |
| Na2CO3固体(NaHCO3) |
① |
② |
| Fe2O3粉末(Al2O3) |
③ |
④ |
(1)配平氧化还原反应方程式:
▲ C2O42- +▲ MnO4- +▲ H+=▲ CO2 +▲ Mn2++▲ H2O
(2)称取5.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至16mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为▲ mol;
②第二份溶液中滴加0.10mol·L-1的酸性高锰酸钾溶液至12 mL时反应完全,则该溶液中还原剂的物质的量为▲ mol;
③原试样中H2C2O4·2H2O的质量分数是▲和KHC2O4的质量分数是▲。
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是▲> ▲> ▲。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是▲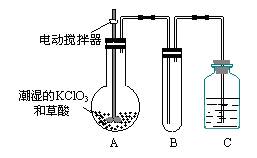
(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置▲;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是▲ _(填“A、B或C”),理由是▲
③C中应装的试剂为 ▲。
C中发生反应的离子方程式为:▲。