铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是 。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了 。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示) 。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为 。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题:
(1)正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法正确的是________。
| A.能使酸性KMnO4溶液褪色 |
| B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反
应的化学方程式
(4)写出与苯互为同系物且一氯取代产物只有两种的物质的结构简式
(举两例):__________________、__________________。
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是(填序号).
(2)①是______________(填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________。
F1的结构简式是________________。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________。
已知某烃类化合物A的相对分子质量为84:
(1)若分子中含有一个碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
A中的碳原子是否都处于同一平面?(填“是”或者“不是”)。
(2)若分子中无碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
其名称为
请根据官能团的不同对下列有机物进行分类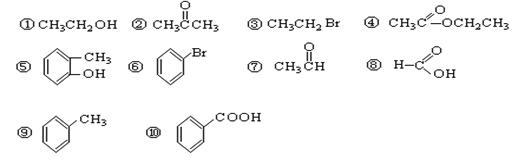
(1)芳香烃: ;(2)卤代烃:;
(3)醇: ;(4)酚: ;(5)醛: ;
(6)酮: ;(7)羧酸: ;(8)酯:。
(Ⅱ)
⑴键线式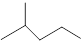 表示的分子式。
表示的分子式。
⑵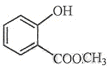 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶书写该物质的名称: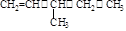
今有分子量为58的几种有机物,试推断符合条件的有机物的分子式或结构简式
(1)若该有机物为烃,则分子式为,其中带有支链的同分异构体在核磁共振氢谱图中有个吸收峰
(2)若该有机物是一种饱和一元脂肪醛,则其与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则其结构简式为,(注羟基连在双键上的有机物极不稳定)该物质生成高分子化合物的化学方程式为。