(共18分)某化学兴趣小组在加热下利用二氧化锰与浓盐酸反应来制取并收集氯气。
(1)制取氯气时在烧瓶中加入一定量的二氧化锰,通过 (填仪器名称)向烧瓶中加入适量的浓盐酸,写出该反应的化学方程式 。
(2)这种装置制取得到的氯气中可能含有少量 气体和 气体,若要得到纯净干燥的氯气,应使气体依次通过装有 和 的洗气瓶。
(3)上述反应中,氧化剂是
(4)反应结束后还可能有少量的氯气,为了防止污染空气,必须把尾气通入 中,写出反应的离子方程式
(5)该小组若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为 0.5mol(填“大于”、“等于”或“小于”),原因是 。
(6)87g二氧化锰与足量的浓盐酸反应,问生成的氯气在标况的体积为多少?参加反应的盐酸中被氧化的那部分的物质的量是多少?(相对原子质量:Mn—55 O—16 要求写出计算格式)
某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④,⑤,⑥;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示):;
(3)写出第⑤步操作中可能发生反应的离子方程式:
;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:
;
(5)你认为该设计里哪些步骤调换后不影响实验结果:;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:
。
用18 mol/L 的浓硫酸配制100 mL 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解
④检漏、转移、洗涤⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是(用下列编号填空)。
| A.10ml | B.25ml | C.50ml | D.100ml |
(2)第③步实验的操是。
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线;改用向容量瓶中滴加蒸馏水至为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)转移溶液和直接加蒸馏水于容量瓶中要注意“两靠”:一靠是盛溶液的烧杯口靠在玻璃棒上部,二靠是玻璃棒下端靠在。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”、“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水;
②所用过的烧杯、玻璃棒未洗涤;
③加水超过刻度线后,用胶头滴管吸出多余的液体。
(10分)为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺。某同学根据该原理设计的实验装置如图: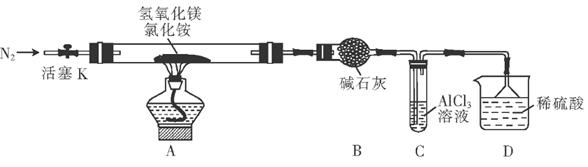
请回答下列问题:
(1) 装置A中发生反应生成碱式氯化镁的化学方程式为_____________;装置B中碱石灰的作用是_______。
(2) 反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_____________________。
(3) 装置C的试管中产生的现象是______________,反应的离子方程式为
某化学小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下图所示:
(1)步骤①中氧化铜与盐酸反应的离子方程式是______________________________。
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是__________。
(3)已知:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe |
1.9 |
3.2 |
Fe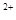 |
7.0 |
9.0 |
Cu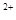 |
4.7 |
6.7 |
提供的试剂:a. NaOH b. H O O c. Na c. Na CO CO d. CuO d. CuO |
参照表中给出的数据和试剂,请回答:
步骤②的目的是_______________________,反应的离子方程式是_________________。
步骤③中调节溶液pH的范围是__________,试剂Y是__________(填字母)。
(4)在步骤④中所进行的一系列操作是______________________________。
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl ·2H
·2H O,其作用是____________________________________。
O,其作用是____________________________________。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为:漂白粉固体和浓盐酸,相关的化学反应方程式为:___________________________________。
(2)装置B中饱和食盐水的作用是_______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为__________色,说明氯的非金属性大于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是__________。
(6)装置F的作用是__________,有人提出,F中的药品可改用足量的NaHSO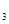 溶液,判断改用NaHSO
溶液,判断改用NaHSO 溶液是否可行__________(填“是”或“否”)。如果答“否”,用离子方程式解释原因____________________(答“是”则不用解释)。
溶液是否可行__________(填“是”或“否”)。如果答“否”,用离子方程式解释原因____________________(答“是”则不用解释)。