下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合: [Cl-]=[Na+]>[H+]>[OH-] |
| B.0.1mol/L pH=4的NaHB 溶液中:[HB-]>[H2B]>[B2-] |
| C.在NaHA溶液中一定有[Na+]+[H+]=[HA-]+[OH-]+[A2-] |
| D.[NH4+]相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液: |
[(NH4)2SO4]<[(NH4)2CO3]<[NH4Cl]
将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是()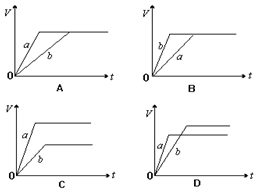
在一定温度下,反应2HBr(g) 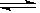 H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是()
H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是()
| A.减小压强 | B.缩小体积 | C.降低温度 | D.增大氢气的浓度 |
用pH试纸测某溶液的pH时,规范的操作是()
| A.将pH试纸放入溶液,观察其颜色变化,跟标准比色卡比较 |
| B.用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| C.用蒸馏水湿润pH试纸,用玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| D.在试管内放入少量溶液煮沸,把pH试纸放在试管口上观察,跟标准比色卡比较 |
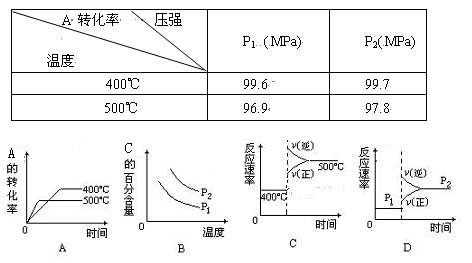
可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图像错误的是()
2C(g),根据下表中的数据判断下列图像错误的是()
下列措施或事实能用勒沙特列原理解释的是( )
| A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成 |
| B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 |
| C.钢铁在潮湿的空气中更容易生锈 |
| D.氯气可以用排饱和食盐水的方法收集 |