(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH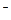 、Al(OH)3、NO
、Al(OH)3、NO 、N2,请将各粒子分别填入以下空格内。
、N2,请将各粒子分别填入以下空格内。 NO3—+ + + +
NO3—+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如右图,则合金的质量为 克。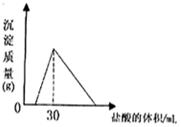
有机物A(C10H20O2)具有兰花香味,可用做香皂、洗发香波的芳香赋予剂。已知:
①B分子中没有支链。②D能与碳酸氧钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种。④F可以使溴的四氯化碳溶液褪色。
(1)D可以发生的反应有(选填序号)。
①取代反应②消去反应③加聚反应④氧化反应
(2)C分子所含的官能团的结构简式是____,F分子中所含的官能团的名称是____。
(3)任意写出一种与D、E具有相同分子式且属于乙酸酯类的物质结构简式:____
(4)B→C的化学方程式是_,C发生银镜反应的离子方程式为。
(5)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2一甲基—1—丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:____。
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(+6价)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe.Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:
其中A、B、C都是钨的化合物。回答:
(1)碱熔时,钨酸亚铁转化为氧化铁和钨酸钠,写出相应反应的化学方程式____。
(2)操作2的名称是,实验室中证明沉淀B是否洗净的方法是;实验室中焙烧需要的主要仪器有____;
(3)写出用氢气还原氧化钨制取金属钨的化学方程式;;为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,因为____。
(4)某种蓝色氧化钨的化学式可以表示为WO2.8,一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这五价钨与六价钨的原子数目之比为:_ ___。
现有五种短周期主族元素A、B、C、 D、E,其原子序数依次增大。A原子约占宇宙中原子总数的88.6%,A+又称为质子:B是形成化合物种类最多的元素,C元素的最简单的氢化物Y的水溶液显碱性.E是短周期元素中电负性最小的元素。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式____。
(2)向氯化亚铁溶液滴加过量的E的最高价氧化物对应水化物的溶液,现象是____。
(3)Y溶液显碱性的原因是(用一个离子方程式表示)____。
(4)检验汽车尾气中含有的化合物BD的方法是:向酸性PdC12溶液中通A汽车尾气,若生成黑色沉淀(Pd),证明汽车尾气中含有BD。写出反应的离子方程式____。
(5)下列有关物质性质的比较中.不正确的是。
a.热稳定性:H2S>SiH4 b.离子半径:Na+>S2-
c.第一电离能N>O d.元素电负性:C>H
(6)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
由上述方程式可知.CH3OH的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol.则表示氢气燃烧热的热化学方程式为____。
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下: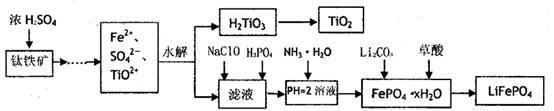
已知:H2LiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的
(2)TiO2+水解生成H2TiO3的离子方程式
(3)加入NaClO发生反应的离子方程式
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁己全部转化为二价铁离子),采取KMnO4标准液漓定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果。 (填“偏高、偏低、无影响”),滴定终点的现象。滴定分析时,称取a g钛铁矿,处理后,用cmol/LKMnO4标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
有机物H(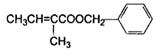 )是一种重要的香精素,有关合成路线如下:
)是一种重要的香精素,有关合成路线如下:
(1)反应④的反应类型 ;F的结构简式
(2)E中含有的官能团名称 :A的名称是
(3)E有多种同分异构体,其中一种满足以下条件:
①与E碳链结构相同:②核磁共振氢谱显示有五种氢:③能发生银镜反应。得到的有机产物酸化后能发生酯化反应生成五元环状分子。
请写出该同分异构体的结构简式:
(4)写出反应⑥的化学方程式:
(5)下列有关G的说法正确的是 。
a.能使酸性KMnO4溶液褪色,或溴的CCl4溶液褪色
b.既能发生取代反应,也能发生加成反应
c.1molG物质完全燃烧耗8.5molO2
d.能与Na2CO3反应,不能与NaOH反应