有机物H(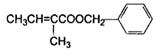 )是一种重要的香精素,有关合成路线如下:
)是一种重要的香精素,有关合成路线如下:

(1)反应④的反应类型 ;F的结构简式
(2)E中含有的官能团名称 :A的名称是
(3)E有多种同分异构体,其中一种满足以下条件:
①与E碳链结构相同:②核磁共振氢谱显示有五种氢:③能发生银镜反应。得到的有机产物酸化后能发生酯化反应生成五元环状分子。
请写出该同分异构体的结构简式:
(4)写出反应⑥的化学方程式:
(5)下列有关G的说法正确的是 。
a.能使酸性KMnO4溶液褪色,或溴的CCl4溶液褪色
b.既能发生取代反应,也能发生加成反应
c.1molG物质完全燃烧耗8.5molO2
d.能与Na2CO3反应,不能与NaOH反应
通过《化学与生活》模块的学习,请你从衣食住行各方面谈谈怎样才能使自己身心发展更健康更科学?
全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A、B、C三支试管中进行研究。
(1)请你帮助该学生完成下列实验设计的内容:
| 编号 |
操作方法 |
实验目的 |
| A |
探究铁在干燥空气中的生锈情况 |
|
| B |
放入铁钉,注入蒸馏水浸没铁钉并用植物油液封 |
|
| C |
探究铁在有空气和水时的生锈情况 |
(2)一周后,编号为________的试管中的铁钉最易生锈。证明铁生锈的条件是:。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在新疆吐鲁番比安装在昆明滇池海埂大坝(填“更易”或“更难”)生锈。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
造成下列现象与什么物质相关:
赤潮,水俣病,地方性甲状腺肿大,贫血。
大米的主要成分是:(填化学式);苷氨酸的结构简式是:;
写出一个检验葡萄糖的化学反应方程式:
钢含碳量为:;玻璃、陶瓷、水泥一定含 _____元素;
油脂在体内水解后的产物是: ____