有一种融雪剂,其主要成分的化学式为XY2, X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是;Y与氢元素形成的化合物的电子式是。
(2)元素D.E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D原子的电子排布式;D与E能形成一种非极性分子,该分子的立体构型名称为。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是。
(14分)(Ⅰ)、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)写出该反应的化学方程式________________________。
(2)该反应中的还原剂是;还原产物是____________。
(Ⅱ)四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,就如何检验这四种溶液分别解答下列各题。
在四支试管中分别取四种溶液各1mL,做下列实验。
(1)在四支试管中分别滴入,出现 现象的,是,
现象的,是,
(2)在剩余三支试管中分别滴入,出现现象的,是,
(3)在剩余两支试管中分别滴入,出现现象的,是,三次实验中都没有明显现象的是。
下图每一方框中的字母代表一种反应物或生成物: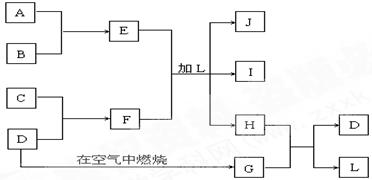
产物J是含A金属元素的胶状白色沉淀,可由E与氨水反应制取。I为氯化钠溶液,D是淡黄色固体单质。试填写下列空白:
(1)F的化学式为 :_________________。
:_________________。
(2)L的化学式为:______________。
(3)写出J受热分解反应的化学方程式:____________________。
(4)H和G之间反应的化学方程式为:________________________。
(5) E与氨水反应的离子方程式_______________________。
某有机物A(C10H10O2)可发生以下变化;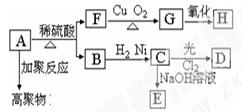
已知D分子结构中无-CH3,F的分子式为C7H8O,含苯环,与FeCl3溶液不显色。 请回答:
请回答:
(1)B分子中含有的官能团是__________、________。(写名称)
(2)A的结构简式是______________________。
(3)B→C的反应类型______________________。
A→F的反应类型______________________。
(4)与F互为同分异构体的芳香族化合物有几种________。
(5)用方程式表示F→G、_____________________________________。
我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其间发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
。
(2)配平离子反应方程式:__H3AsO3+__I2+__H2O— __H3AsO4+__I-+__H+
(3)0.2%的淀粉溶液的作用是,如何判断滴定到达终点?。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为mg/kg,故该草药样品(填“合格”或“不合格”)。