(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)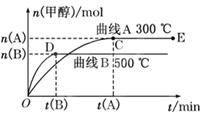
根据题意完成下列问题:
(1)反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________.
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的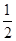 ,下列有关该体系的说法正确的是____.
,下列有关该体系的说法正确的是____.
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时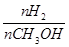 增大 增大 |
明矾净水原理(离子方程式)_____________________________
硬水软化的方法有:,。
生活垃圾一般可以分为、、;
人们常用_____________来表示空气质量。空气污染指数是根据空气中_______、_________和________等污染物的浓度计算出来的数值。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是。不采用铜跟浓硫酸反应来制取硫酸铜的原因是
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积(填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为