在Cl-、NH4+、HSO4-、Na+、HCO3-五种离子中,既不能电离又不能水解的离子是_______________,只能水解不能电离的离子是_____________,只能电离不能水解的离子是______________,既能电离又能水解的离子是_____________。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称),以下三种说法中,可以验证该结论的是(填写编号);
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
(3)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
(4)B2A4是一种可燃性液体,B2A4—空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2。用该燃料电池电解足量的饱和食盐水,如下图所示,电解装置内发生反应的离子方程式为__________________________________________;检验Y极产物的方法是___________________________________________________
______________________________;每生成0.1mol该产物,燃料电池中消耗B2A4的物质的量为___________。
(1)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知: N2(g) + 2O2(g) = 2NO2(g)△H = 67.7kJ·mol-1
N2H4(g) +O2(g) = N2(g) +2H2O (g)△H = -543 kJ·mol-1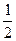 H2(g) +
H2(g) + 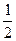 F2(g) = HF (g)△H = -269 kJ·mol-1
F2(g) = HF (g)△H = -269 kJ·mol-1
H2(g) +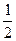 O2(g) = H2O (g)△H = -242 kJ·mol-1
O2(g) = H2O (g)△H = -242 kJ·mol-1
①肼和NO2反应的热化学方程式为:
_____。
②有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子。以戊烷(C5H12)代表汽油,完成下列问题:
①电池反应方程式为;
②放电时固体电解质里的O2-离子的移动方向是向极移动(填“正”或“负”)
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)选择性催化还原法的脱硝原理为:
6NOx+4x NH3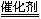 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为________L。
②已知:2H2(g)+O2(g) =2H2O (g)ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g)ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g)ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=__________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(N O)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
O)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
①出该脱硝原理总反应的化学方程式:____________。
②为 达到最佳脱硝效果,应采取的条件是____________。
达到最佳脱硝效果,应采取的条件是____________。
下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。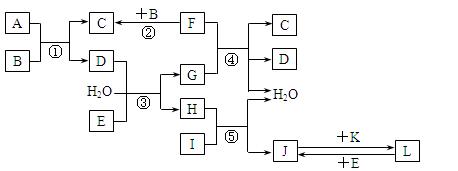
请回答下列问题:
(1)C的电子式为_____________。
(2)检验溶液L中金属阳离子的方法是__________________。
(3)反应③的离子方程式为____________________________。
(4)F与G的浓溶液反应的化学方程式为__________________。
(5)气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为________。
(1)物质X、Y是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
①若X为氧化物,X的化学式是____________。
②若X与稀硫酸反应生成无色无味的气体A ,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与足量稀氢氧化钠溶液反应的离子方程式是___________________________。
③若X为金属单质,写出X与氢氧化钠溶液反应的化学方程式__________________;若Y为非金属单质,Y不能与浓、稀硫酸反应,却能与某种酸反应放出氢气,并与氢氧化钠溶液反应放出氢气。写出Y与氢氧化钠溶液反应的化学方程式并用单线桥法标明电子的转移_________________________。
(2)在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是_________________________________ 。
科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是______________。