试回答下列问题:
⑴指出下列实验用品或仪器(已洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质)
②容量瓶  (2)下列实验中所选用的仪器或操作以及结论合理的是____________。
(2)下列实验中所选用的仪器或操作以及结论合理的是____________。
A.用托盘天平称量5.85 g氯化钠晶体 |
B.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4溶液和CH3COOH溶液 |
C.用碱式滴定管量取25.00 mL高锰酸钾溶液 |
D.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠 |
 E. 量筒内液体体积读数为10.0 mL时,全部倒入烧杯内的实际体积也是10.0 mL
E. 量筒内液体体积读数为10.0 mL时,全部倒入烧杯内的实际体积也是10.0 mL F. 100 mL容量瓶内液面正好达到刻度线时,全部倒入烧杯内的实际体积也必为100 mL
F. 100 mL容量瓶内液面正好达到刻度线时,全部倒入烧杯内的实际体积也必为100 mL (3)欲量取15.00 mL Na2CO3溶液,应选用的仪器是_________________。
(3)欲量取15.00 mL Na2CO3溶液,应选用的仪器是_________________。 (4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行___________次。
(4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行___________次。
(届陕西省延安市秋高考模拟理综化学试卷)
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程________________。
(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_______
II.实验装置如图所示:
(1)写出浓硝酸受热分解的化学方程式:__________________________________。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?________(填“正确”或“不正确”),理由是。
III.为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。_________________________________________________。
(届北京市海淀区高三第二学期适应性练习理综化学试卷)
某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
| 序号 |
浓硝酸与水的体积比 |
实验现象 |
| Ⅰ |
1:1 |
反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ |
1:3 |
反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ |
1:5 |
反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
铜与稀硝酸反应的离子方程式为;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。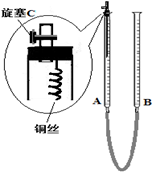
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到,说明装置的气密性良好。
②步骤Ⅲ操作的目的是。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是,能确定NO完全被溶液吸收的现象是。
(届东北三省四市高三第一次模拟考试理综化学试卷)
铁触媒(铁的氧化物)是合成氨工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和。
(2)若通入Cl2不足量,溶液B中还含有会影响测定结果。
(3) 若通入Cl2过量且加热煮沸不充分,溶液B中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol L-1酸性KMnO4溶液、紫色石蕊试液、淀粉-KI溶液、0.1mol L-1 KSCN溶液、 品红稀溶液
| 实验操作 |
实验现象与结论 |
| 取适量溶液B于试管中,滴加,振荡 ,放置一段时间后,观察现象。 |
若溶液,则溶液B中含Cl2; 若溶液,则溶液B中不含Cl2。 |
方案二 :用下列装置测定铁触媒的含铁量,确定其组成。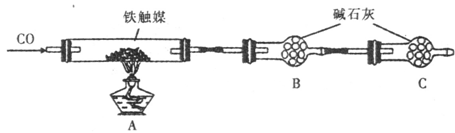
(4)干燥管C的作用是。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得干燥管B增重ll.0g,则该铁触媒的化学式可表示为。
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为。
(2)用B装置制CO2,使用该装置优点的是。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是、。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+②。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经、洗涤、、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是。
氯离子插层镁铝水滑石 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为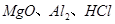 和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
(1) 热分解的化学方程式为。
热分解的化学方程式为。
(2)若只通过测定装置C、D的增重来确定 ,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
(3)加热前先通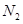 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入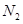 的作用是、等.
的作用是、等.
(4)完全分解后测得C增重3.65g、D增重9.90g,则 =.若取消冷却玻管B后进行试验,测定
=.若取消冷却玻管B后进行试验,测定 值将(填“偏高”或“偏低”)
值将(填“偏高”或“偏低”)
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1—2y(CO3)y·zH2O],该生成物能发生类似的热分解反应,现以此物为样品,用(2)中连接的装置和试剂进行实验测定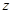 ,除测定D的增重外,至少还需测定 .
,除测定D的增重外,至少还需测定 .