在二氧化碳的水溶液中存在着如下平衡:
C02(g) C02(aq) C02(aq)+H20
C02(aq) C02(aq)+H20 H2C03(aq)
H2C03(aq)
H2C03(aq) H+ (aq)+HCO3-(aq) HCO3-(aq)
H+ (aq)+HCO3-(aq) HCO3-(aq)  H+(aq)+CO32-(aq)
H+(aq)+CO32-(aq)
下列有关说法正确的是( )
| A.水中溶解的二氧化碳的浓度,夏天时比冬天时高 |
| B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高 |
| C.气压升高,水中c(HCO3-)增大 |
| D.常温下,二氧化碳的水溶液中,由水电离出的c(H+)与c(OH-)的乘积等于1×lO-14 |
下列说法不正确的是
| A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 |
B.已知Cr2O72-+H2O 2CrO42-+2H+,向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明平衡发生了移动 2CrO42-+2H+,向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明平衡发生了移动 |
| C.将NO2和N2O4混合气体的平衡体系加压,容器内气体颜色变深,这一事实不能用勒夏特列原理解释 |
D.在密闭容器中,对于反应2A(g)+B(g) 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 |
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是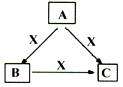
A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3
C.若X为O2,则A一定为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 |
结论 |
|
| A |
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 |
该电极为阳极 |
| B |
向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 |
氧化性:Cu2+>Fe3+ |
| C |
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和 盐酸,水垢溶解 |
溶解度:S(CaCO3)< S(CaSO4) |
| D |
向某溶液中先滴加硝酸,再滴加BaCl2溶液,有白色沉淀生成 |
该溶液中含有Ag+ |
下列说法正确的是:①Cl-的结构示意图 ②羟基的电子式
②羟基的电子式 ;③HClO的结构式:H—Cl—O;④NaHCO3在水中的电离方程式:
;③HClO的结构式:H—Cl—O;④NaHCO3在水中的电离方程式: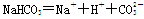 ;⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化
;⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化
| A.①②⑤ | B.①④⑥⑦ | C.①②③⑥ | D.①②③⑤ |
NA为阿伏加德罗常数,下列说法中正确的是
| A.标准状况下,22.4L CCl4中含有的CCl4分子数为NA |
| B.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA |
| C.1.0 L 浓度为18mol·L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA |
| D.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA |