硅单质及其化合物应用范围很广。请回答下列问题:
制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: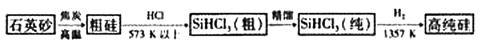
(1)在制粗硅的反应中,焦炭的作用是 。
(2)整个制备过程必须严格控制无水、无氧。
①SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;②H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出
实验现象并给予解释 。
(1) 2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
请回答下列问题: ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。 ②图中△H= 。
②图中△H= 。
( 2 )由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) + O2(g) = H2O( l )的ΔH= 。氢气的燃烧热为ΔH= 。
O2(g) = H2O( l )的ΔH= 。氢气的燃烧热为ΔH= 。
2015年“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫:(请用图中物质前的序号连接起来表示所走的路线)______________。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有______个,属于氧化还原反应的有____个。其中能“吃掉”盐酸的盐是__________(填物质名称),写出该反应的离子方程式_______________;
(3)在不能与盐酸反应的物质中,属于电解质的是__________ (填写物质序号)。
Ⅰ、下表中括号内物质是杂质,试将除杂试剂及分离方法填入表内:
| 混合物 |
Fe ( Al) |
H2O(I2) |
| 除杂试剂 |
||
| 除杂方法 |
Ⅱ、等温等压下,等体积的O2和O3所含分子个数比为________, 质量之比为________。
Ⅲ、将适量的铁粉加入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+的物质的量浓度相等,则已反应的Fe3+和原溶液中的Fe3+的物质的量之比为 ;将绿豆大一粒钠投入硫酸铜溶液中,写出总的化学方程式 。
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
(1)写出B的结构简式 ;A中官能团的名称为 。
(2)写出下列反应的化学方程式反应① ;反应④ ;
(3)实验室利用反应③制取C,常用上图②装置:
①a试管中的主要化学反应的方程为: 。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
③试管b中观察到的现象是 。
(1)某烃A 0.2mol在氧气中充分燃烧后,生成化合物B,C各1.2mol,试回答:
①烃A的分子式为 ,生成的B、C通过足量的过氧化钠可得到O2 _________g。
②若取一定量的烃A燃烧后生成的B、C各3mol,则有 mol烃A参加了以应。
③若烃A不能因反应而使溴的四氯化碳溶液褪色,且A在一定条件下能与氯气发生取代反应,所得一氯化物的结构只有一种,则A的结构简式为 。
④若A为烯烃,则 A的同分异构体有 种。
(2)已知C—C键可以绕键轴自由旋转,结构简式为
①有 个碳原子共线。
②至少 个碳原子共面。
③至多 个碳原子共面。