已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的PH:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| PH值 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
表中数据提示出复分解反应的一条规律,即碱性较强的物质发生类似反应可生成碱性较弱的物质。依据该规律,请你判断下列反应不能成立的是:
| A.CO2 +H2O+ NaClO="=" NaHCO3+HClO | B.CO2 +H2O+ 2NaClO="=" Na2CO3+2HClO |
| C.CH3COOH+ NaCN="=" CH3COONa+HCN | D.CH3COOH+ NaClO="=" CH3COONa+ HClO |
某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是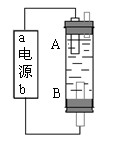
A.电源中“a”为负极,“b”为正极
B. 电解池中的电解液不可以是NaCl溶液
C.B电极发生的反应:2H2O+2e-=H2↑+2OH-
D.A.B两端都必须使用铁作电极
一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O |
| C.通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2- |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2 = 4CO2 + 5H2O |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件下一定能够发生 |
| C.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热 |
| D.吸热反应在一定条件下(如常温、加热等)也能发生 |
甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则两容器中的反应速率
| A.甲快 | B.乙快 | C.相等 | D.无法确定 |
下列说法正确的是
| A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大; |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大; |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数; |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率。 |