在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为____。
(2)根据右图写出该反应的化学方程式_______,该反应的平衡常数表达式为K=__________。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是_____(填“放热”或“吸热”)反应,反应的平衡常数____(填“增大”、“减小”或“不变”。下同),B的反应速率______。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是___。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下: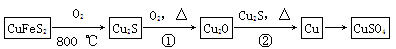
回答下列问题:
(1)基态铜原子的电子排布式为,硫、氧元素相比,第一电离能较小的元素是(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是,其立体结构是。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液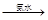 蓝色沉淀
蓝色沉淀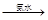 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为pm。(用含d和NA的式子表示)。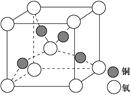
海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下: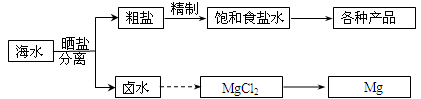
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为,制取它的化学方程式为。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
d.将MgCl2•6H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为。
②步骤d中的“一定条件”指的是。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?(填“同意”或“不同意”),请说出你同意或不同意的理由。
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策。科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)K1(Ⅰ)
NaNO3(s)+ClNO(g)K1(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g)K2(Ⅱ)
2ClNO(g)K2(Ⅱ)
回答下列问题:
(1)写出反应(Ⅰ)的平衡常数表达式K1 =。
(2)恒温恒容条件下,反应(Ⅱ)达到平衡的标志是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和ClNO的物质的量相等
d.每消耗0.1 mol NO的同时消耗0.05 mol Cl2
(3)为研究不同条件对反应(Ⅱ)的影响,恒温时向2 L密闭容器中加入 0.2 mol NO和0.1mol Cl2:
①在恒容条件下反应10 min达到平衡,测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,
则NO的平衡转化率α1=。
②在恒压条件下建立平衡时NO的转化率为α2,则α2α1(填“>”“<”
或“=”),平衡常数K2(填“增大”、“减小”或“不变”)。
(4)工业上可通过电解NO制备NH4NO3,其工作原理如图所示,阴极反应式为;为使电解产物全部转化为NH4NO3,需补充气体物质A,A的化学式是_________。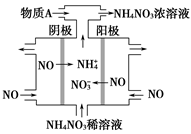
(5)NO2可助偏二甲肼(C2H8N2)燃烧,产生的巨大能量能把火箭送入太空。已知6.0g液态偏二甲肼与液态NO2完全反应生成N2、CO2、H2O(g)放出225.0kJ的热量。写出该反应的热化学方程式。
[化学---选修5:有机化学基础]
已知: (-R表示烃基)
(-R表示烃基) 苯甲醇+苯甲酸钾
苯甲醇+苯甲酸钾
可由下列反应路线合成结晶玫瑰(只列出部分反应条件)
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的名称是。
(2)C中的官能团是_____________。
(3)反应③的化学方程式为____________________。
(4)经反应路线④得到的副产物加水萃取、分液,能除去的副产物是。
(5)已知: ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为。
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为。
(6)G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为(只写一种)。
(7)⑥的化学方程式是。
(8)C有多种同分异构体,其中属于芳香族化合物的有种(不包括C)。
[化学——选修3:物质结构与性质]已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;B的最外层电子数为其内层电子数的3倍;A与C可形成离子化合物C3A2;D是地壳中含量最多的金属元素;E原子核外的M层中有两对成对电子;F原子核外最外层只有1个电子,其余各层电子均充满。根据以上信息,回答下列问题:(A、B、C、D、E、F用所对应的元素符号表示)。
(1)F原子的核外电子排布式为,A、B、C、D、E的第一电离能最小的是。
(2)C的氧化物的熔点远高于E的氧化物的熔点,原因是。
(3)比较B、E的氢化物的沸点_________。
(4)A的最高价含氧酸根离子中,其中心原子是杂化,E的低价氧化物的空间构型为。
(5)A、D形成某种化合物的晶胞结构如图1,则其化学式为。
(6)F单质的晶体的晶胞结构如图2。若F原子的半径是r cm,则F单质的密度的计算公式是。(用NA表示阿伏伽德罗常数)