(8分)(1)微粒2311Na+ 中质子数是_______,中子数是______,核外电子数是_______。
(2)下列3种不同粒子 11H、21H、31H表示______种元素,______种核素,11H、 21H、 31H互称为_________,它们的化学性质_______。(填“相似”或“不同”)
(3)2412Mg表示Mg原子核外电子所占据的电子层中,能量最高的是______层(填符号)。
(8分)某烯烃与H2发生加成反应后得到的产物是CH3CH(CH3)2。
(1)该产物用系统命名法名命,其名称是;该产物的一氯代物有种。
(2)原来烯烃的结构简式为。
(3)写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:__________________________________。
②甲装置中碳极的电极反应式是___________ _______,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:
_______________________________________________________________________。
选做[有机化学]]邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一
试回答:
(1)I中含氧官能团的名称和。
(2)II→III的反应类型。
(3)①IV与乙醇和浓硫酸混合加热的化学方程式。
②IV与过量NaOH溶液反应的化学方程式。
(4)有机物X与IV互为同分异构体,且X有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出X的一种结构简式。
选做[物质结构与性质](10分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为______<______<______ (填元素符号)。
(2)E元素基态原子的电子排布式为________________________________。
(3)XZ2的分子中含有个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________。
(5)将YH3通入灼热EZ中发现黑色固体变红色,生成物对大气不造成污染。请写出有关化学方程式。
(12分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y的氢化物和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。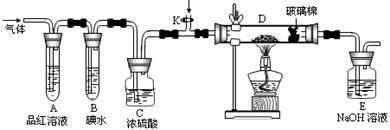
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 |
| B.稀盐酸 |
| C.稀硝酸 |
| D.氯化钙 |
E.双氧水
F.硝酸银