如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:__________________________________。
②甲装置中碳极的电极反应式是___________ _______,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:
_______________________________________________________________________。
多晶硅是太阳能光伏产业的重要原材料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s)=SiO(g)+CO(g) ΔH=a kJ·mol-1
2SiO(g)=Si(s)+SiO2(s) ΔH=b kJ·mol-1
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式为________________________________。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:
SiHCl3(g)+H2(g)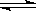 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。
不同温度及不同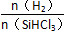 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。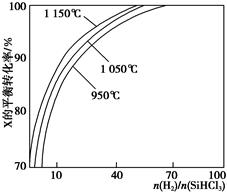
①X是________(填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1 150 ℃)________K(950 ℃)(填“>”、“<”或“=”)。
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔融盐电解法制取硅烷原理如图所示,电解时阳极的电极反应式为_________________________________________。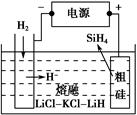
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为________。
当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
①C(s)+O2(g)=CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g)ΔH2=+ 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式。
(3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是。
A、B、C、D、E是五种原子序数依次递增的短周期元素,已知:其中只有一种是金属元素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素原子质子数的2倍;B的最外层电子数是电子层数的两倍;C、A可形成两种常见的液态化合物甲和乙,且相对分子质量乙比甲大16。
(1)E元素的名称为:;D的原子结构示意图为。
(2)化合物乙中含有的化学键是(填“极性共价键”或“非极性共价键”)。
(3)A单质与B、C形成的化合物可合成一种新型汽车动力燃料甲醇。
已知CO(g)+1/2O2(g)=CO2(g)
ΔH=-283 kJ/mol
H2(g)+1/2O2(g)===H2O(g)ΔH=-242 kJ/mol
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)
ΔH=-651 kJ/mol
写出A与所选化合物合成甲醇的热化学方程式:。
(4)EC2与C、D形成的化合物发生氧化还原反应的化学方程式为:。
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)=2HCl(g)ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)=CH4(g)的反应热ΔH为 。
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
4.7 |
2.7 |
7.6 |
| 完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。