T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g) +O2(g)  2SO3(g) △H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol。
2SO3(g) △H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol。
(1)T℃时,该反应的平衡常数K的数值为 。
(2)另有容器乙和丙均分别充入2molSO2、1molO2,起始容器容积与甲相同,起始温度均为T℃。在反应过程中乙容器保持温度和压强不变,丙容器保持容器体积不变并与外界绝热,分别建立平衡后:
①三个容器中反应的平衡常数K:K(甲) K(乙) K(丙)(选填“>”、“<”或“=”)。
②达到平衡时,甲、乙、丙三容器中,SO2的转化率α最小的是 容器,混合气体密度ρ最大的是 容器。
(3)若向上述容器甲的平衡体系中继续充入2mol SO2和1mol O2,在相同温度下再次达到平衡后,SO3的物质的量 (填字母)。
a.2.4mol b.大于1.2mol,小于2.4mol c.大于2.4mol
呋喃酚是合成农药的重要中间体,其合成路线如下:
(1)A物质核磁共振氢谱共有个峰,B→C的反应类型是,E中含有的官能团名称是,D不能够发生的反应有(填代号)。
①氧化反应 ②取代反应 ③加成还原 ④消去反应
(2)已知X的分子式为C4H7Cl,写出A→B的化学方程式:。
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是。
(4)下列有关化合物C、D的说法正确的是。
①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式:。
①环上的一氯代物只有一种
②含有酯基
③能发生银镜反应
醛类是有机合成中的重要原料,特别是对有机物碳链增长起着重要的桥梁作用。
如醛类在一定条件下有如下反应:
CH3CHO+Br—CH—COOC2H5CH3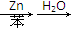 CH3—CH—CH—COOC2H5OHCH3
CH3—CH—CH—COOC2H5OHCH3
用CH3—CH—COOHOH通过以下路线可合成(G):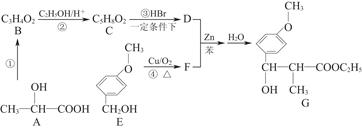
(1)反应①的条件是。
(2)B的结构简式为,其核磁共振氢谱显示分子内有3种不同环境的氢原子,其个数比为。
(3)反应②和④的类型是、。
(4)D与足量的热NaOH溶液反应的化学方程式为。
(5)F的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物W,W的结构简式为。
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱合成路线如图: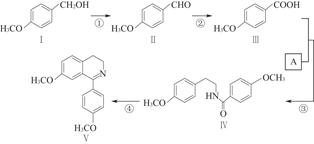
(1)化合物Ⅱ的化学式为。
(2)反应①的化学方程式为(不要求写出反应条件)。
(3)化合物A的结构简式为。
(4)下列说法正确的是。
| A.化合物Ⅱ能发生银镜反应 |
| B.化合物Ⅰ~Ⅴ均属于芳香烃 |
| C.反应③属于酯化反应 |
| D.化合物Ⅱ能与4 mol H2发生加成反应 |
E.化合物Ⅰ、Ⅱ、Ⅲ均能与金属钠反应放出氢气
(5)化合物Ⅵ与化合物Ⅲ互为同分异构体,Ⅵ中含有酯基,且能与FeCl3溶液发生显色反应,其苯环上的一氯代物只有2种。写出一种满足上述条件的Ⅵ的结构简式:。
(6)化合物Ⅶ(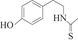 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
对乙酰氨基苯酚F(CH3C—NHOOH)是常用的非甾类消炎解热镇痛药。F可用如下路线来合成:
(1)若A分子的核磁共振氢谱只有一个吸收峰,且能使溴水褪色,则A的结构简式为。
(2)反应①的反应类型是,反应②的反应类型是。
(3)F的同分异构体有多种,写出两种满足下列条件的F的同分异构体的结构简式。
①苯环上有两个取代基;
②苯环上的一卤代物只有两种;
③能发生水解反应,水解产物之一遇FeCl3溶液显色。
、。
(4)F在NaOH溶液中水解的化学方程式为。
(5)D的同分异构体W结构简式为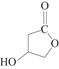 。下列关于W的说法正确的是( )
。下列关于W的说法正确的是( )
a.可与HBr反应生成溴代物
b.可发生消去反应,消去产物有两种
c.1 mol发生催化氧化反应后的产物可与2 mol H2发生加成反应
d.常温下可与Na2CO3溶液反应
H是一种人工合成的香料,其合成路线可简单表示如下: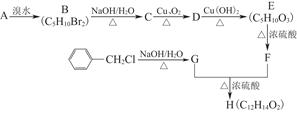
已知A的结构简式为CCH3—CH2CH3CH2,F的分子结构中含有2个甲基。
请回答下列问题:
(1)C中官能团的名称为,G的核磁共振氢谱中有组峰,H的结构简式为。
(2)写出反应D→E的化学方程式:。
E在一定条件下生成的高分子化合物的结构简式为__。
(3)写出符合下列条件的F的3种同分异构体的结构简式:。
①属于酯类②含有1个甲基③能与溴水发生加成反应④能发生银镜反应