下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______ ,
(3)写出⑤的最高价氧化物跟⑨的最高价氧化物的水化物在水溶液中反应的离子方程式___________
(4)写出②的最低价氢化物跟它的氧化物的水化物形成的所有化合物的化学式 _______
该化合物中含有的化学键有______________
有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L。D的M层上有7个电子。
(1) A、B、C、D各是什么元素(写元素符号):
ABCD
(2)用电子式表示C与D形成化合物的过程:
。
(3)写出B、D的最高价氧化物的水化物反应的离子方程式:
。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至5min Z的平均反应 速率为, X的转化率为;
速率为, X的转化率为;
(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为____________________。
(2)B中Sn极的电极反应式为____________________,
Sn极附近溶液的pH___________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是____ ____________________。
____________________。
(1)下列反应中,属于放热反应的是,属于吸热反应的是。
①燃烧反应②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳
⑤食物因氧化而腐败⑥Ba(OH)2·8H2O与NH4Cl反应⑦铁粉与稀盐酸反应
(2)写出(1)中⑥的化学方程式。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同, 根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是。
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3OCH3 |
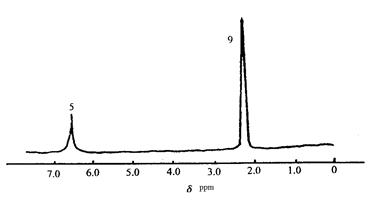
(2)化合物A和B的分子 式都是C2H4Br2, A的核磁共振氢谱图如下图所示,则A的结构简式为:,请预测B的核磁共振氢谱上有个峰(信号)。
式都是C2H4Br2, A的核磁共振氢谱图如下图所示,则A的结构简式为:,请预测B的核磁共振氢谱上有个峰(信号)。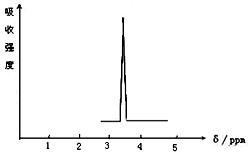
(3)化合物C的分子式是C10H14,核磁共振氢谱图如 下图所示,则C的结构简式为:。
下图所示,则C的结构简式为:。