(10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,____ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
②湿式氧化法的流程如下图:
上述流程中制备Na2FeO4的化学方程式是: 。
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
已知A为芳香烃,分子结构中只含有一个带甲基的侧链。5.9 gA完全燃烧,生成19.8 g CO2。W为B的同分异构体,其结构简式为

(1)A的分子式为,H的结构简式为;
(2)C的官能团名称为;
(3)发生取代反应的有(填反应序号);
(4)⑤的化学方程式为;
(5)符合下列3个条件的G的同分异构体的数目有个,写出其中任意一个同分异构体的结构简式。
①含有邻二取代苯环结构;②与G有相同官能团;③不与FeC13溶液发生显色反应。
a、b、c、d、e为短周期主族元素。其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁。
请回答:
(1)a元素为____,甲的分子式为,丁的电子式为。
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应,写出一个符合要求的化学反应方程式:。
(3)a单质和丙可形成燃料电池(以KOH溶液为电解质)。该燃料电池的负极反应式为
。
(4)乙是一种液态火箭燃料,在O2中燃烧,产物无污染。常温下,6.4 g乙燃烧放出QkJ热量,该反应的热化学方程式为____。
现有A、B、C、D、E、F六种常见化合物 ,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
①测得A溶液呈碱性,E溶液的pH为1,C溶液的酸性强于E溶液。
②向B溶液中滴入D溶液,出现白色沉淀和无色无味气体,该白色沉淀既能溶于A溶液,又能溶于C溶液;过滤,向滤液中加入A溶液,加热,有刺激性气味气体产生。
③向B溶液中滴加F溶液,产生白色沉淀,加入过量E溶液,沉淀不溶解。
④向E溶液中滴加F溶液,无明显变化。
根据上述实验现象,回答下列问题:
(1)写出下列四种化合物的化学式:
A、B、D、F。
(2)C溶液是,判断依据是____
(3)B、D反应的离子方程式是____;
(12分)图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。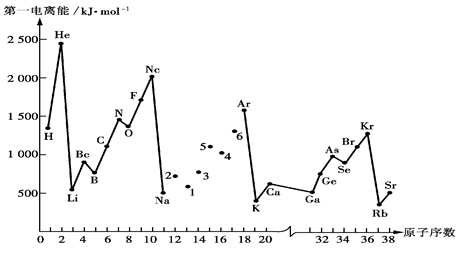
①将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
①经验规律告诉我们: 当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________________________________________________________。
请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2 分子的键角是__________。
分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如 [Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
[Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
(4)利用CO可以合成化工原料COCl2,其中
①COCl2分子的结构式为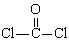 ,②COCl2分子内含有(填标号);
,②COCl2分子内含有(填标号);
A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键D.3个σ键、1个π键