工业上对海水资源综合开发利用的部分工艺流程如下图所示。

(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是。电解槽中的阳极材料为。
(2)本工艺流程中先后制得、和,能否按、、的顺序制备?原因是。
(3)膜在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氧化碳,原因是
373K时,某 1L密闭容器中加入1mol NH3发生如下可逆反应: 2NH3(g) N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
(1)前 20 s内NH3(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率(填“增大”或“减小”,下同)。NH3的平衡浓度。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
d.再充入N2
水是自然界中普遍存在的一种物质,根据下列信息回答问题: (1)
(1) 氧原子基态时价层电子的电子排布图为________________。
氧原子基态时价层电子的电子排布图为________________。
(2)已知2H2O = H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为_________。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由。
稳定性: 理由:
理由: 。
。
沸点:理由:。
请将氧化还原反应:2Fe3++2I— 2Fe2++I2设计成带盐桥原电池。
2Fe2++I2设计成带盐桥原电池。
试剂:FeCl3溶液,KI溶液;其它用品任选。请回答下列问题。
(1)请画出设计的原电池装置图,并标出电极材料,电极名称及电解质溶液。
(2)发生还原反应的电极为电池的极,其电极反应式为。
(3)反应达到平衡时,外电路导线中(填“有”或“无”)电流通过。
(4)平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此时该溶液中电极变为(填“正”或“负”)极。
(5)请设计简单实验,证明溶液中同时存在Fe3+、Fe2+。
今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
| 组别 |
① |
② |
③ |
④ |
| V[FeCl3(aq)]/mL |
100 |
100 |
100 |
100 |
| 混合粉末质量/g |
6 |
13.2 |
24 |
36 |
| 反应后剩余固体质量/g |
0 |
1.28 |
12.8 |
24.8 |
(1)试判断第②组剩余固体的成分为 ;
;
(2)原混合粉末中Fe、Cu的物质的量之比为;
(3)第①组所得溶液的Fe2+的物质的量浓度为。
已知:①苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢,例如:
②苯的同系物(如甲苯、乙苯等)能被酸性高锰酸钾氧化为苯甲酸,例如:
根据以下转化关系(生成物中所有无机物均已略去),回答下列问题: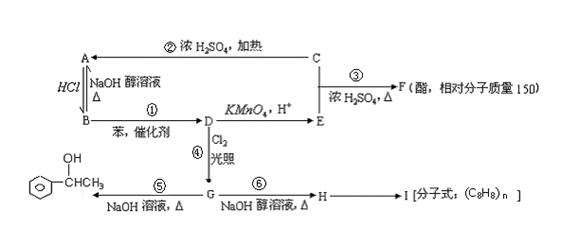
(1)在①~⑥六个反应中,属于取代反应的是(填反应编号)。
(2)写出物质的结构简式F,I。
(3)能与FeCl3溶液反应呈紫色的E的同分异构体有种。
(4)写出下列化学方程式:
B →D:;
G →H:。