完成下列化学反应方程式,并指出反应类型。
(1)乙醛和银氨溶液反应(水浴加热)
(2)向少量苯酚稀溶液中加入饱和溴水
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,
测得c(CO)= 0.2 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)
ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池负极的电极反应式为。
② 工作一段时间后,测得溶液的pH将(填“增大”、“减小”、“不变”)。 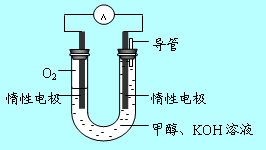
根据下列框图关系填空。已知常温下X为无色液体,D、E均为无色气体,
G是一种重要的工业产品。C的焰色反应为黄色,E、F的相对分子量之间的关系为
M(F)=M(E)+16。回答下列问题: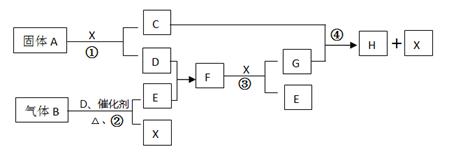
(1)A中化学键的类型为,写出B的一个用途。
(2)将固体A加入FeCl3溶液中的主要现象是。
(3)写出气体B的水溶液与CuSO4溶液反应的离子方程式。
(4)写出反应②的化学方程式。
(5)经测定,反应④中每生成1.0gX,放出3.2KJ的热量(常温下)。试写出反应④
的热化学方程式。
已知:①A是石油裂解气里的主要气体
(1)写出A物质的名称;D物质的结构简式。
(2)写出反应②的类型;反应⑥的类型。
(3)写出反应⑤ 的化学方程式:。
的化学方程式:。
(4)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出
它的结构简式:
(5)分子中具有苯环,苯环上含有两个取代基,且能与NaHCO3溶液反应的E的同分异构体有种(不包含E)。
请根据右图装置,回答相关问题:
(1)C池属于什么装置______。
(2)写出电极上发生的反应:②_____________,③___________。
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是________。
(4)当电路上有0.2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
Ⅰ.已知:R-CH=CH-O-R′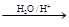 R-CH2CH
R-CH2CH O + R′OH
O + R′OH 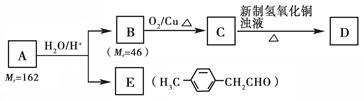
(烃基烯基醚)
烃基烯基醚A的相对分子质量( M r)为162。与A相关的反应如下:
M r)为162。与A相关的反应如下:
请回答下列问题:
(1)B的结构简式为_________________。
(2)写出C → D反应的化学方程式:______________________ ______。
______。
Ⅱ.由E转化为对甲基苯乙炔(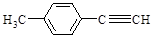 )的一条路线如下:
)的一条路线如下: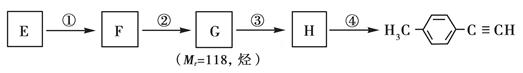
(3)写出F的结构简式:____________,第③步反应的化学方程式为____________________。
第④步的反应类型为