现有下列十种物质:
①H2 ②Cu ③Na2O ④CO2 ⑤H2SO4
⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧碘酒 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(填写序号):
| 分类标准 |
混合物 |
氧化物 |
电解质 |
| 属于该类的物质 |
|
|
|
(2)⑩在水中的电离方程式为 。
(3)写出下列物质之间反应的离子方程式:
少量的④通入⑥的水溶液 。
⑤的水溶液与⑥的水溶液混合 。
(4)质量都是10 g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是 ;密度最小的是__ ____。(填分子式)
(5)②与⑨发生反应的化学方程式为:3Cu + 8HNO3 (稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O,__ __ __是氧化剂,__ __ __元素被氧化,参加反应的HNO3中,n(HNO3)被还原∶n(HNO3)未被还原= ,当有6.4gCu发生反应时,转移电子的物质的量为 mol。
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作: 
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用(填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的实验条件是。
(9分) 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: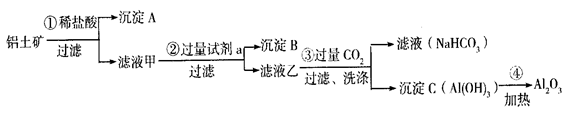
① 沉淀  A、B的成分分别是、;步骤②中的试剂a是;
A、B的成分分别是、;步骤②中的试剂a是;
② 试写出步骤③中发生反应的离子方式__________、
____________________;
③简述检验所得滤液甲 中存在Fe3+的操作方法:___________。
中存在Fe3+的操作方法:___________。
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化关系如下,反应①~④均为化合反应。回答下列问题:
(1)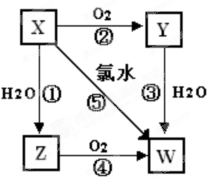
Y的化学式为___________,
Z的化学式为____________。X直接排入空气中
易造成的环境问题是_______________________。
(2)反应①~⑤中属于氧化还原反应的是_______________________________。
(3)写出反应⑤的化学方程式:_______________________________________________。
(4)写出铜与W反应的化学方程式:____________________________________________
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O,
(1)、请将Au2O3之外的反应物与生成物分别填入以下空格内。
Au2O3 ++ → + + 。
(2)、反应中被还原的元素是,还原剂是。
(3)、将氧化剂和还原剂填入下列空格中,并标出电子转移的方向和数目。
+ +……
(4)、纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl ,则还原剂与氧化剂物质的量之比为 。
写出下列物质的电离方程式
① KAI (SO4)2
②NaHCO3
写出下列反应的离子方程式
③ 氢氧化铜溶于盐酸
④硫酸氢钠溶液中滴加纯碱溶液
写出离子反应方程式CO2+2OH-= CO32-+H2O所对应的两个化学方程式
⑤
⑥